कुछ यौगिकों को स्थिरता प्राप्त करने के लिए वैलेंस शेल में आठ इलेक्ट्रॉनों की आवश्यकता नहीं होती है, इसलिए उन्हें ऑक्टेट नियम के अपवाद माना जाता है। अब जानें कि कुछ तत्व अंतिम कोश में इलेक्ट्रॉनों के एक अष्टक होने की बाध्यता से क्यों बचते हैं।
फीरोज़ा (होना)
यह ऑक्टेट नियम का अपवाद है क्योंकि यह दो एकल बंधों के साथ यौगिक बनाने में सक्षम है, इसलिए यह वैलेंस शेल में केवल चार इलेक्ट्रॉनों के साथ स्थिर होता है। 
चूँकि हाइड्रोजन (H) को आबंध बनाने के लिए दो इलेक्ट्रॉनों का त्याग करना पड़ता है (एच - खैर - एच), बेरिलियम (बीई) परमाणु अपने इलेक्ट्रॉनों को साझा करता है और स्थिरता प्राप्त करता है।
अल्युमीनियम (अल)
यह ऑक्टेट नियम का अपवाद है क्योंकि यह संयोजकता कोश में छह इलेक्ट्रॉनों के साथ स्थिरता प्राप्त करता है। एल्युमिनियम परमाणु अपने इलेक्ट्रॉनों को दान करता है और इसलिए अन्य परमाणुओं के साथ तीन एकल बंधन बना सकता है: 
इस मामले में, एल्युमिनियम (Al) ने तीन फ्लोरीन (F) परमाणुओं के साथ तीन बंधन बनाए।
बोरान (बी)
यह तीन एकल बंधों के साथ आणविक पदार्थ बनाता है। 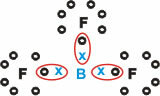
ध्यान दें कि बोरॉन (बी) अपने इलेक्ट्रॉनों को फ्लोरीन (एफ) परमाणुओं को दान करता है, जो ऑक्टेट नियम का पालन करता है, जिसके लिए वैलेंस शेल में आठ इलेक्ट्रॉनों की आवश्यकता होती है। जैसे ही बोरॉन अपने इलेक्ट्रॉनों को छोड़ देता है, फ्लोरीन बनने वाले ऑक्टेट के साथ स्थिर हो जाता है।
लिरिया अल्वेस द्वारा
रसायन विज्ञान में स्नातक
ब्राजील स्कूल टीम
और देखें!
अष्टक सिद्धांत
सामान्य रसायन शास्त्र - रसायन विज्ञान - ब्राजील स्कूल
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm

