ए इलेक्ट्रोस्फियर परमाणु का वह क्षेत्र है जिसमें इलेक्ट्रॉन वे स्थित हैं. इलेक्ट्रोस्फीयर, अधिक सटीक रूप से, परमाणु कक्षाओं से बना है, जो श्रोडिंगर समीकरण को हल करके निर्धारित किया जाता है। सबसे पहले रदरफोर्ड के मॉडल द्वारा निर्धारित, बोह्र के परमाणु मॉडल की वैधता के दौरान इलेक्ट्रोस्फीयर को महत्वपूर्ण प्रगति प्राप्त हुई।
इलेक्ट्रोस्फियर को परतों (या ऊर्जा स्तरों) में विभाजित किया जा सकता है, क्योंकि इलेक्ट्रॉनों ने (गैर-निरंतर) ऊर्जा को परिभाषित किया है। दो या दो से अधिक इलेक्ट्रॉनों वाले परमाणुओं के लिए, कोश उपकोश (या उपकोश) में विभाजित होते हैं। परमाणु के गुणों को समझने और रासायनिक बंधों के निर्माण को समझने के लिए इलेक्ट्रोस्फीयर बेहद महत्वपूर्ण है।
यह भी पढ़ें: परमाणु का विभाजन कैसे होता है?
इलेक्ट्रोस्फीयर के बारे में सारांश
इलेक्ट्रोस्फीयर परमाणु का वह क्षेत्र है जिसमें इलेक्ट्रॉन स्थित होते हैं।
यह परमाणु कक्षाओं, तरंग कार्यों से बना है जो श्रोडिंगर के समीकरणों के समाधान हैं।
इसकी अवधारणा अर्नेस्ट रदरफोर्ड के मॉडल से शुरू हुई।
परमाणु नाभिक के प्रति आकर्षण के कारण इलेक्ट्रॉन इलेक्ट्रोस्फीयर में रुके रहते हैं।
इलेक्ट्रोस्फीयर को समझने में मुख्य प्रगति नील्स बोह्र के मॉडल की अवधारणा के दौरान हुई।
यह परतों (या ऊर्जा स्तरों) से बना है, जो परिभाषित ऊर्जा के क्षेत्र हैं।
एक से अधिक इलेक्ट्रॉन वाले परमाणुओं के लिए, कोश उपकोश (या उपकोश) में विभाजित होते हैं।
इलेक्ट्रोस्फीयर कई गुणों को समझने के लिए महत्वपूर्ण है, जैसे परमाणु समानता, स्थिरता, परमाणु त्रिज्या, आयनीकरण ऊर्जा, इलेक्ट्रॉन बन्धुता, बंधों के निर्माण को समझने के अलावा रसायन.
इलेक्ट्रोस्फीयर पर वीडियो पाठ
इलेक्ट्रोस्फीयर क्या है?
इलेक्ट्रोस्फीयर को इस प्रकार परिभाषित किया गया है परमाणु संरचना का वह क्षेत्र जिसमें इलेक्ट्रॉन स्थित होते हैं. अधिक गहन व्याख्याओं में, हम कहते हैं कि यह परमाणु कक्षाओं, तरंग कार्यों से बना है जो श्रोडिंगर के समीकरण के समाधान हैं। किसी परमाणु कक्षक की गणितीय अभिव्यक्ति, जब वर्गित की जाती है, तो किसी दिए गए बिंदु पर इलेक्ट्रॉन के स्थान की संभाव्यता घनत्व प्रस्तुत करती है।
हे इलेक्ट्रोस्फीयर की अवधारणा किसके साथ उभरनी शुरू हुई? अर्नेस्ट रदरफोर्ड का परमाणु मॉडल, जिसमें इलेक्ट्रॉन एक घने, धनात्मक नाभिक के चारों ओर परिक्रमा करते हैं। बाद में, नील्स बोह्र ने क्वांटम यांत्रिकी की अवधारणाओं को मिलाकर इलेक्ट्रोस्फीयर की अधिक महत्वपूर्ण व्याख्याएँ पेश कीं।
इलेक्ट्रोस्फीयर की परतें
परमाणु नाभिक के प्रति आकर्षण के कारण इलेक्ट्रॉन इलेक्ट्रोस्फीयर में रुके रहते हैं। हालाँकि, यह ज्ञात है कि ये इलेक्ट्रॉन कोशों में होते हैं जिनकी ऊर्जाएँ अच्छी तरह से परिभाषित होती हैं. ऐसी परतों को ऊर्जा स्तर भी कहा जा सकता है।
यह निष्कर्ष स्पेक्ट्रोस्कोपी प्रयोगों के बाद आया। उदाहरण के लिए, जब गैस H पर विद्युत धारा लगाई जाती है2 कम दबाव पर, प्रकाश H द्वारा उत्सर्जित होता है2. इस स्थिति में H आयन बनते हैं+ और इलेक्ट्रॉन, जो H आयनों में वापस आ जाएंगे+ और एच की उत्तेजित (ऊर्जावान) प्रजातियां बनाएगा+. अतिरिक्त ऊर्जा को राहत देने के लिए, एच आयन+ ऊर्जा को विद्युत चुम्बकीय विकिरण (प्रकाश) के रूप में छोड़ें और H गैस में पुनः संयोजित करें2 दोबारा।
आपको याद होगा कि जब सफ़ेद प्रकाश किसी प्रिज्म से होकर गुजरता है, तो वह एक सतत स्पेक्ट्रम (इंद्रधनुष के समान) में टूट जाता है; हालाँकि, H से आने वाले प्रकाश के साथ ऐसा नहीं होता है2: जब ऐसा विकिरण प्रिज्म से होकर गुजरता है, तो एच उत्सर्जन स्पेक्ट्रम में केवल परिभाषित तरंग दैर्ध्य वाली चमकदार रेखाएं देखी जाती हैं2, वर्णक्रमीय रेखाओं के रूप में जाना जाता है।
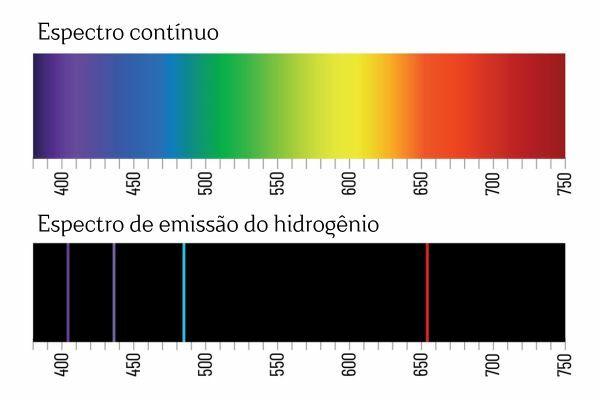
तत्वों के उत्सर्जन स्पेक्ट्रा की व्याख्या (अच्छी तरह से परिभाषित वर्णक्रमीय रेखाओं के साथ) यह है एक इलेक्ट्रॉन, एक परमाणु में, कोई ऊर्जा प्रस्तुत नहीं कर सकता, बल्कि अच्छी तरह से परिभाषित मात्रा में प्रस्तुत कर सकता है (तथाकथित ऊर्जा पैकेट)। यदि इलेक्ट्रॉनों पर ऐसे ऊर्जावान प्रतिबंध नहीं होते, तो तत्वों का उत्सर्जन स्पेक्ट्रम निरंतर होता, जैसे कि एक प्रिज्म से गुजरने वाली सफेद रोशनी।
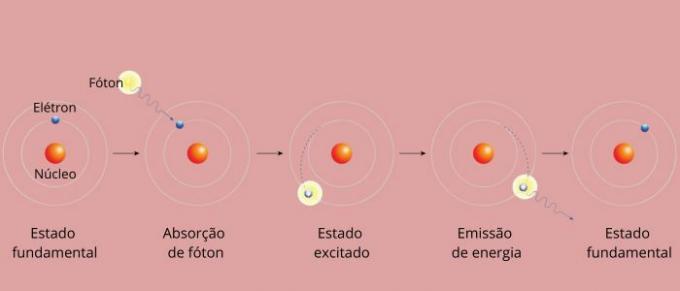
किसी तत्व की प्रत्येक वर्णक्रमीय रेखा को ऊर्जा स्तर के रूप में जाना जाने लगा। (या परत, जैसा कि हम कहने के अधिक आदी हैं)। ये रेखाएँ तब उत्पन्न होती हैं जब एक इलेक्ट्रॉन एक अनुमत ऊर्जा स्तर से दूसरे ऊर्जा परिवर्तन की प्रक्रिया में गुजरता है, जिसे इलेक्ट्रॉनिक संक्रमण के रूप में जाना जाता है।
इलेक्ट्रॉनिक संक्रमण के दौरान, इलेक्ट्रॉन निम्न ऊर्जा स्तर से उच्च ऊर्जा स्तर की ओर जाता है। अपने प्रारंभिक स्तर पर लौटने पर यह विद्युत चुम्बकीय विकिरण (प्रकाश) के माध्यम से अतिरिक्त ऊर्जा उत्सर्जित करता है वर्णक्रमीय रेखा की उत्पत्ति जिसका उत्सर्जित ऊर्जा मान समीकरण द्वारा परिभाषित मान के समानुपाती होता है रिडबर्ग।
जोहान्स रिडबर्ग एक स्वीडिश स्पेक्ट्रोस्कोपिस्ट थे जिन्होंने स्विस प्रोफेसर जोहान बामर के काम के आधार पर वर्णक्रमीय रेखाओं की प्रवृत्ति को परिभाषित करने के लिए एक समीकरण बनाया था। प्रत्येक परत की विशिष्ट ऊर्जा को उचित श्रोडिंगर समीकरण को हल करके परिभाषित किया गया है।
प्रत्येक इलेक्ट्रॉनिक परत में कई इलेक्ट्रॉनों की अनुमति होती है. वर्तमान में, सात इलेक्ट्रॉनिक परतों को परिभाषित किया गया है, जिन्हें वर्णमाला क्रम में K से Q अक्षरों द्वारा या अक्षर n द्वारा पहचाना जाता है, जहां n ≥ 1 है। इस प्रकार, परत K वह परत है जहां n = 1, इत्यादि। प्रति शेल में अनुमत इलेक्ट्रॉनों की संख्या निम्न तालिका में दिखाई गई है।
ऊर्जा स्तर |
परत |
इलेक्ट्रॉनों की अधिकतम संख्या |
1 |
क |
2 |
2 |
एल |
8 |
3 |
एम |
18 |
4 |
एन |
32 |
5 |
हे |
32 |
6 |
पी |
18 |
7 |
क्यू |
8 |
हाइड्रोजनॉइड परमाणुओं के लिए (केवल 1 इलेक्ट्रॉन के साथ, जैसे H, He+, ली2+), सभी परमाणु कक्षकों की ऊर्जा समान होती है (हम उन्हें पतित कक्षक कहते हैं); हालाँकि, दो या दो से अधिक इलेक्ट्रॉनों वाले परमाणुओं में, एक बहुत ही महत्वपूर्ण प्रभाव उत्पन्न होता है, इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण। इस तथ्य का परिणाम यह होता है कि प्रत्येक परत की कक्षाओं में अलग-अलग ऊर्जाएँ होने लगती हैं और इसलिए, परतों को उपपरत (या उपस्तर) के रूप में वर्णित किया जाने लगता है।
वर्तमान परमाणुओं के लिए, प्रत्येक परत को अधिकतम चार उपस्तरों में विघटित किया जा सकता है, अक्षर "s" द्वारा दर्शाया गया है (अंग्रेजी से, तीखा), "पी" (अंग्रेजी से, मुख्य), "डी" (अंग्रेजी से, प्रसार) और "एफ" (अंग्रेजी से, मौलिक).
प्रत्येक उपस्तर गणना और प्रयोगों द्वारा परिभाषित अधिकतम संख्या में इलेक्ट्रॉनों का समर्थन करता है। "एस" उपस्तर 2 इलेक्ट्रॉनों तक का समर्थन करता है; "पी" उपस्तर, 6 इलेक्ट्रॉनों तक; "डी" उपस्तर, 10 इलेक्ट्रॉनों तक; और "एफ" उपस्तर, 14 इलेक्ट्रॉनों तक। K परत एकमात्र ऐसी परत है जो केवल एक कक्षीय की अनुमति देती है और इसलिए, इसमें केवल एक ही उपस्तर होता है।
ऊर्जा स्तर |
परत |
उपस्तर |
1 |
क |
1s |
2 |
एल |
2s, 2p |
3 |
एम |
3एस, 3पी, 3डी |
4 |
एन |
4s, 4p, 4d, 4f |
5 |
हे |
5s, 5p, 5d, 5f |
6 |
पी |
6एस, 6पी, 6डी |
7 |
क्यू |
7एस, 7पी |
इलेक्ट्रोस्फीयर का कार्य
प्रत्येक परमाणु का विद्युतमंडल इसका उपयोग परमाणु के विभिन्न गुणों और व्यवहारों को समझाने के लिए किया जा सकता है.
परमाणु त्रिज्या, आयनिक त्रिज्या, आयनीकरण ऊर्जा और इलेक्ट्रॉन आत्मीयता जैसे गुणों में ऐसे मूल्य होते हैं जो इलेक्ट्रोस्फीयर के इलेक्ट्रॉनिक विन्यास का प्रत्यक्ष परिणाम होते हैं, विशेष रूप से वैलेंस शेल कहा जाता है, जो वास्तव में किसी परमाणु या आयन का सबसे बाहरी व्याप्त इलेक्ट्रॉनिक आवरण है।
ए आवर्त सारणी में एक ही समूह के परमाणुओं के बीच समानता भी इलेक्ट्रॉनिक विन्यास का परिणाम है वैलेंस शेल का. रासायनिक प्रक्रियाओं में, हम यथासंभव आवर्त सारणी पर एक ही समूह से परमाणुओं को चुनते हैं प्रतिस्थापन, और यह केवल प्रशंसनीय है, क्योंकि इन परमाणुओं की परत में समान इलेक्ट्रॉनिक विन्यास होता है वैलेंस का.
तक रासायनिक बन्ध, जो आयनिक और सहसंयोजक यौगिकों (अणुओं) को बनाने के लिए परमाणुओं के बीच होता है, परमाणुओं के इलेक्ट्रोस्फियर के बीच बातचीत के माध्यम से भी होता है।
ये भी पढ़ें: श्रोडिंगर का परमाणु मॉडल - क्वांटम यांत्रिकी का उपयोग करके परमाणु का वर्णन करने का तरीका
इलेक्ट्रोस्फीयर और परमाणु संरचना के बीच संबंध
जैसा कि उल्लेख किया गया है, इलेक्ट्रोस्फीयर परमाणु के उस क्षेत्र को शामिल करता है जिसमें इलेक्ट्रॉन पाए जा सकते हैं। इलेक्ट्रॉन, विशेष रूप से, परमाणु कक्षाओं में स्थित होते हैं, जिनकी ऊर्जा क्वांटम गणना द्वारा परिभाषित होती है।
इलेक्ट्रोस्फीयर परमाणु संरचना का सबसे बड़ा क्षेत्र हैचूँकि परमाणु का नाभिक बहुत छोटा होता है। परमाणु को एक फुटबॉल स्टेडियम के रूप में सोचते हुए, नाभिक मैदान के केंद्र में एक गेंद के अनुरूप होगा, जबकि स्टेडियम का बाकी हिस्सा इलेक्ट्रोस्फीयर होगा।
फिर भी, द्रव्यमान के संदर्भ में, इलेक्ट्रोस्फियर का योगदान बहुत कम है. चूंकि इलेक्ट्रॉनों का द्रव्यमान प्रोटॉन और न्यूट्रॉन के द्रव्यमान से लगभग 1836 गुना छोटा है, हम कह सकते हैं कि परमाणु का लगभग पूरा द्रव्यमान नाभिक में केंद्रित है।
इलेक्ट्रोस्फीयर पर हल किए गए अभ्यास
प्रश्न 1
(Fasisb 2023) हाइड्रोजन परमाणु के लिए बोह्र के मॉडल में, इलेक्ट्रॉन केवल कुछ कक्षाओं पर ही कब्जा कर सकता है। इनमें से कुछ कक्षाओं को चित्र में दर्शाया गया है, जहां n प्रत्येक कक्षा में इलेक्ट्रॉन के ऊर्जा स्तर को संदर्भित करता है।
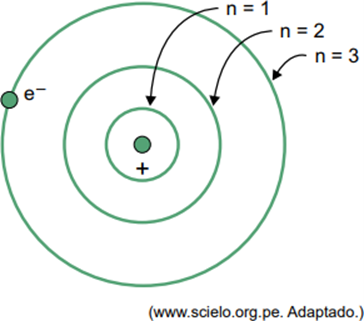
विचार करें कि, हाइड्रोजन परमाणु में, इलेक्ट्रॉन उस कक्षा में है जहां n = 5 है।
बोह्र मॉडल के अनुसार यह इलेक्ट्रॉन तभी विद्युत चुम्बकीय विकिरण के रूप में ऊर्जा उत्सर्जित करेगा
(ए) उस कक्षा में संक्रमण करें जिसमें एन 6 के बराबर है।
(बी) कक्षा में रहें जहां एन = 5।
(सी) किसी भी कक्षा में संक्रमण जिसमें एन 5 से अधिक है।
(डी) किसी भी कक्षा में संक्रमण जिसमें एन 5 से कम है।
(ई) परमाणु से बाहर निकाला जाता है, इसे आयनित करता है।
उत्तर: अक्षर डी
जब एक इलेक्ट्रॉन बाहरी आवरण में होता है, तो कम ऊर्जा के साथ आंतरिक आवरण में लौटने पर, यह विद्युत चुम्बकीय विकिरण (प्रकाश) के रूप में अतिरिक्त ऊर्जा छोड़ता है। इसलिए, प्रकाश की घटना तभी घटित होगी जब n = 5 में मौजूद इलेक्ट्रॉन एक आंतरिक कोश में संक्रमण करेगा।
प्रश्न 2
(उर्ज 2019) हाल ही में, वैज्ञानिक उच्च दबाव में आणविक हाइड्रोजन को संपीड़ित करके धात्विक हाइड्रोजन का उत्पादन करने में कामयाब रहे। इस तत्व के धात्विक गुण आवर्त वर्गीकरण तालिका के समूह 1 के अन्य तत्वों के समान हैं।
यह समानता इन तत्वों के सबसे ऊर्जावान उपस्तर से संबंधित है, जो इससे मेल खाती है:
(ए) एन.एस1
(बी) एन.पी.2
(सी) ना3
(डी) एनएफ4
उत्तर: अक्षर A
हाइड्रोजन परमाणु में केवल एक इलेक्ट्रॉन होता है, जो पहले स्तर, उपस्तर "s" (1s) में स्थित होता है1). इसे आवर्त सारणी के समूह 1 में पाए जाने का एक कारण यह है कि इस समूह के अन्य सभी रासायनिक तत्वों में परमाणु होते हैं जिनका संयोजकता कोश एक ही प्रकार का होता है (एनएस1). इसलिए, एक समान वैलेंस परत के कारण, हाइड्रोजन को इस धात्विक रूप में उत्पादित किया जा सका।
स्रोत:
डू कैंटो, ई. एल.; लेइटे, एल. एल डब्ल्यू.; कैंटो, एल. डब्ल्यू रसायन विज्ञान - रोजमर्रा की जिंदगी में. 1. ईडी। साओ पाउलो: मॉडर्ना, 2021।
एटकिंस, पी.; जोन्स, एल.; लेवरमैन, एल. रसायन विज्ञान के सिद्धांत: जीवन और पर्यावरण पर प्रश्न उठाना. 7. ईडी। पोर्टो एलेग्रे: बुकमैन, 2018।
एटकिंस, पी.; डी पाउला, जे.; कीलर, जे. एटकिन्स की भौतिक रसायन विज्ञान. 11 संस्करण. ऑक्सफोर्ड: ऑक्सफोर्ड यूनिवर्सिटी प्रेस, 2018।
