ऑटो-ऑक्सी-कमी या अनुपातहीन प्रतिक्रिया एक प्रकार की रेडॉक्स प्रतिक्रिया है जिसमें एक ही रासायनिक तत्व गुजरता है ऑक्सीकरण और कमी। आइए इस प्रकार की प्रतिक्रिया के दो उदाहरण देखें और रेडॉक्स विधि का उपयोग करके उन्हें कैसे संतुलित करें:
पहला उदाहरण:
पर2- + एच+ → नहीं3- + नहीं + एच2हे
- प्रतिक्रिया में शामिल सभी परमाणुओं और आयनों के ऑक्सीकरण संख्या (एनओएक्स) की गणना करके, यह सत्यापित करना संभव है कि किसने ऑक्सीकरण किया और किसने प्रतिक्रिया की:
+3 -2 +1 +5 -2 +2 -2 +1 -2
पर2- + एच+ → नहीं3- + नहीं + एच2हे
- ध्यान दें कि नाइट्रोजन वह प्रजाति थी जो प्रतिक्रिया और ऑक्सीकरण दोनों करती थी:
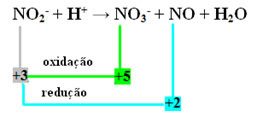
- रेडॉक्स द्वारा इस प्रतिक्रिया को संतुलित करने के लिए, हमें एनओएक्स को उत्पादों से जोड़ना होगा, अभिकर्मकों को नहीं:
पर3- =∆नॉक्स = 5 - 3 = 2
NO=∆Nox = 3 - 2 = 1
- NOX को गुणांकों से बदलने पर, हमारे पास है:
पर3- =∆एनओएक्स= 2 → 2 NO. का गुणांक होगा
नहीं = ∆NOX = 1→ 1 NO. का गुणांक होगा3-
पर2- + एच+ → 1 पर3- + 2 नहीं+एच2हे
- इसके साथ, हम पहले से ही जानते हैं कि उत्पाद में 3 एन हैं, इसलिए NO का गुणांक2- 3 होगा:
3 नहीं2- + एच+ → 1 नहीं3- + 2 नहीं + एच2हे
- H. के गुणांकों को निर्धारित करने के लिए+ और H से2हे, याद रखें कि प्राप्त इलेक्ट्रॉनों की संख्या दान किए गए इलेक्ट्रॉनों की समान मात्रा के बराबर होती है; इस प्रकार, अभिकर्मक चार्ज उत्पाद चार्ज के बराबर होगा। इस प्रकार, हम निम्नलिखित योजना बना सकते हैं:
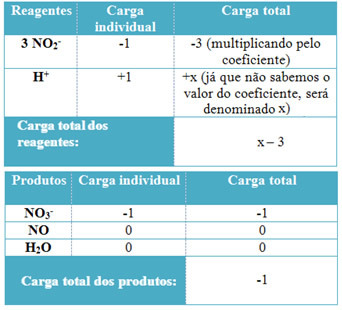
इस जानकारी के आधार पर, हमारे पास यह है कि अभिकर्मकों का कुल प्रभार बराबर है equal एक्स - 3 और उत्पाद के बराबर है -1. जैसा कि कहा गया है, दोनों के आरोप बराबर होने चाहिए। जैसा कि हमारे पास पहले से ही उत्पादों का कुल भार है, हम यह जानने के लिए एक सरल गणना कर सकते हैं कि x का मान क्या होगा:
एक्स -3 = -1
एक्स = -1 +3
एक्स = 2
इस प्रकार, H. का गुणांक+ 2 है और, फलस्वरूप, H. का21 होगा:
3 नहीं2- + 2 एच+ → 1 नहीं3- + 2 नहीं + 1 एच2हे
दूसरा उदाहरण:
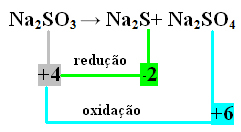
इस मामले में, यह एस था जिसने एक ही समय में कमी और ऑक्सीकरण किया था। इस प्रकार, जैसा कि पहले किया गया था, हम NOX को उत्पादों से जोड़ सकते हैं और उनके मूल्यों को उल्टा कर सकते हैं, उन्हें गुणांक निर्दिष्ट कर सकते हैं:
पर2 एस=∆नॉक्स = 4 - (-2) = 6 → 6 Na. का गुणांक होगा2 केवल4
पर2 केवल4=∆नॉक्स = 6 - 4 = 2 → 2 Na. का गुणांक होगा2 रों
पर2 केवल3→ 2 पर2 वाई+ 6 पर2 केवल4
चूँकि दूसरे अंग में 8 सल्फर होते हैं, Na गुणांक2 केवल3 8 होगा:
8 इंच2 केवल3→ 2 इंच2 एस + 6 इंच2 केवल4
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm