घुलनशीलता, या घुलनशीलता गुणांक, यह पदार्थ का एक भौतिक गुण है जो हमेशा प्रयोगशाला में व्यावहारिक रूप से निर्धारित होता है। यह उस क्षमता से संबंधित है जिसे एक सामग्री कहा जाता है घुला हुआ पदार्थ, दूसरे द्वारा भंग करने के लिए प्रस्तुत करता है, विलायक.
घुलनशीलता के लिए, विलेय को निम्नानुसार वर्गीकृत किया जा सकता है:
घुलनशील: जो विलायक में घुल जाते हैं। सोडियम क्लोराइड (विलेय), उदाहरण के लिए, पानी (विलायक) में घुलनशील है;
अल्प घुलनशील: जिन्हें विलायक में घुलने में कठिनाई होती है। यह कैल्शियम हाइड्रॉक्साइड का मामला है [Ca(OH)2] (विलेय) पानी में;
अघुलनशील: जो विलायक में नहीं घुलते। रेत (विलेय), उदाहरण के लिए, पानी में अघुलनशील है।
घुलनशीलता की तैयारी के साथ बहुत जुड़ा हुआ है समाधान (सजातीय मिश्रण), चूंकि, एक समाधान प्राप्त करने के लिए, यह आवश्यक है कि प्रयुक्त विलेय विलायक में घुलनशील हो।
घुलनशीलता को प्रभावित करने वाले कारक
यहां तक कि जब विलेय विलायक में घुलनशील होता है, तब भी कुछ कारक होते हैं जो विलेय की घुलने की क्षमता को प्रभावित कर सकते हैं। क्या वो:
a) विलेय और विलायक की मात्रा के बीच संबंध
विलायक में हमेशा विलेय की एक सीमा होती है जिसे वह भंग कर सकता है। यदि हम विलेय की मात्रा को बनाए रखते हुए विलायक की मात्रा बढ़ाते हैं, तो विलायक उपयोग किए गए सभी विलेय को भंग कर देता है।
बी) तापमान
तापमान ही एकमात्र भौतिक कारक है जो किसी दिए गए विलेय के संबंध में विलायक की घुलनशीलता को संशोधित करने में सक्षम है। यह संशोधन विलेय की प्रकृति पर निर्भर करता है, जैसा कि हम नीचे देखेंगे:
ऊष्माशोषी विलेय: वह है जिसे हम एक बड़े द्रव्यमान को भंग करने का प्रबंधन करते हैं, जब तक कि विलायक कमरे के तापमान से अधिक तापमान पर हो। विलायक जितना गर्म होगा, विलेय उतना ही अधिक घुलेगा।
उदाहरण: पानी के गर्म होने पर अधिक मात्रा में पिसी हुई कॉफी को घोलना संभव है।
एक्ज़ोथिर्मिक विलेय: यह वह है जिसे हम एक बड़े द्रव्यमान को भंग करने का प्रबंधन करते हैं, जब तक कि विलायक कमरे के तापमान से कम तापमान पर हो। विलायक जितना ठंडा होगा, विलेय उतना ही अधिक घुलेगा।
उदाहरण: सोडा ठंडा होने पर कार्बन डाइऑक्साइड की अधिक मात्रा को भंग करना संभव है।
घुलनशीलता निर्धारित करने के तरीके
चूंकि घुलनशीलता एक प्रयोगात्मक तरीके से निर्धारित संपत्ति है, सामान्य रूप से सामग्री, पहले से ही सबसे अलग सॉल्वैंट्स में उनकी घुलनशीलता का मूल्यांकन कर चुकी है। इस प्रकार, हम एक निश्चित विलायक में विलेय की विलेयता को निम्न प्रकार से प्राप्त कर सकते हैं:
क) एक तालिका का विश्लेषण
अक्सर, छात्र तालिका की व्याख्या से विलेयता का पता लगा सकता है। निम्नलिखित उदाहरण देखें:
उदाहरण: (यूईपीजी - अनुकूलित) नीचे दी गई तालिका ली नमक की घुलनशीलता दिखाती है2सीओ3 100 ग्राम पानी में।

तालिका ली. के ग्राम में द्रव्यमान मान प्रस्तुत करती है2सीओ3 जिसे 0. से 100 ग्राम पानी में घोला जा सकता है हेसी से 50 हेसी। हम देख सकते हैं कि पानी जितना गर्म होगा, उतना ही कम ली2सीओ3 घुल जाता है। इसलिए, लियू2सीओ3 यह एक ऊष्माक्षेपी विलेय है (पानी ठंडा होने पर यह अधिक घुल जाएगा)।
बी) एक ग्राफ का विश्लेषण
एक ग्राफ की व्याख्या करके घुलनशीलता का आकलन किया जा सकता है। ऐसा करने के लिए, बस तापमान निर्धारित करें, इसे वक्र की ओर मोड़ें और फिर वक्र को y अक्ष की ओर मोड़ें, जो कि घुलने वाले विलेय के ग्राम में द्रव्यमान है।
उदाहरण: (UFTM - अनुकूलित) ग्राफ एक AX नमक के घुलनशीलता वक्र को दर्शाता है2.
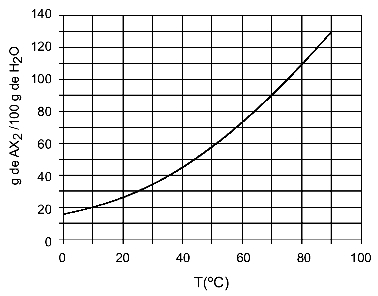
ग्राफ कहता है कि, y-अक्ष पर पानी (विलायक) की मात्रा 100 ग्राम है। विलेय AX. के लिए2, हम निम्नलिखित तापमान पर पानी की मात्रा निर्धारित करेंगे:
30हेसी: जब हम तापमान 30. चालू करते हैंहेसी से वक्र और फिर वक्र से y अक्ष तक, हमारे पास यह है कि, इस तापमान पर, 100 ग्राम पानी लगभग 35 ग्राम विलेय AX को भंग कर सकता है।2.
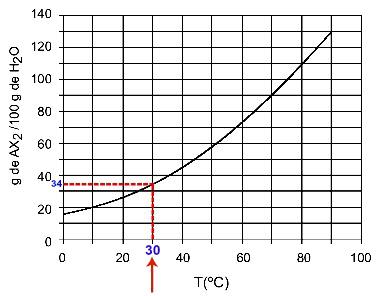
कुल्हाड़ी घुलनशीलता का निर्धारण2 30. परहेसी
40हेसी: जब हम तापमान 40. चालू करते हैंहेसी से वक्र और फिर वक्र से y अक्ष तक, हमारे पास यह है कि, इस तापमान पर, 100 ग्राम पानी लगभग 45 ग्राम विलेय AX को भंग कर सकता है।2.
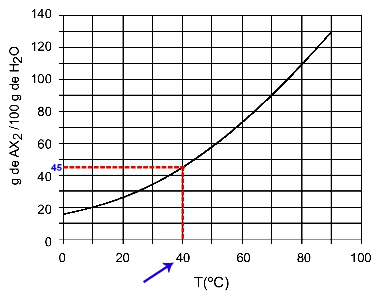
कुल्हाड़ी घुलनशीलता का निर्धारण2 40. परहेसी
चूंकि तापमान में प्रत्येक वृद्धि के साथ विलेय की घुलित मात्रा अधिक होती है, इसलिए हमारे पास वह AX. है2 यह एक एंडोथर्मिक विलेय है।
ग) पाठ्य व्याख्या
निम्नलिखित उदाहरण देखें:
उदाहरण: (पीयूसी-एमजी) कुछ पदार्थ अन्य पदार्थों के साथ सजातीय मिश्रण बनाने में सक्षम हैं। जो पदार्थ सबसे अधिक मात्रा में होता है उसे विलायक कहते हैं और जो सबसे कम मात्रा में होता है उसे विलेय कहा जाता है। सोडियम क्लोराइड (NaCl) पानी के साथ एक सजातीय घोल बनाता है, जिसमें 20ºC, 36 ग्राम NaCl को 100 ग्राम पानी में घोलना संभव है।
पाठ में कहा गया है कि यदि हमारे पास २० of के तापमान पर १०० ग्राम पानी (विलायक) है हेसी, 36 ग्राम NaCl तक भंग करना संभव है।
मेरे द्वारा डियोगो लोपेज डायस
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm
