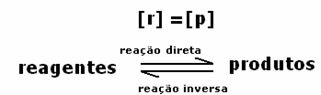
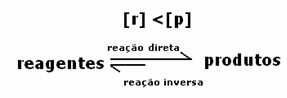
एक प्रतिक्रिया का गतिशील संतुलन या रासायनिक संतुलन तब होता है जब आगे और पीछे की प्रतिक्रियाएं एक साथ होती हैं। इन तथाकथित प्रतिवर्ती प्रणालियों को दोनों दिशाओं में तीरों द्वारा दर्शाया जाता है:  या
या  . प्रतिवर्ती प्रतिक्रिया का एक उदाहरण ऊपर की छवि में आयोडीन गैस और हाइड्रोजन गैस के बीच उद्धृत किया गया है।
. प्रतिवर्ती प्रतिक्रिया का एक उदाहरण ऊपर की छवि में आयोडीन गैस और हाइड्रोजन गैस के बीच उद्धृत किया गया है।
अभिक्रिया के प्रारम्भ में अभिकारकों की मात्रा अधिकतम तथा उत्पादों की मात्रा शून्य होती है। हालांकि, अभिकारक एक दूसरे के साथ प्रतिक्रिया करते हैं, उनकी एकाग्रता कम हो जाती है और बनने वाले उत्पादों में वृद्धि होती है। प्रत्यक्ष प्रतिक्रिया के विकास की दर भी घट रही है।
जैसे-जैसे उत्पादों की सांद्रता बढ़ती है, व्युत्क्रम प्रतिक्रिया शुरू होती है और अभिकारक फिर से बनते हैं; प्रतिलोम अभिक्रिया के विकास की दर भी बढ़ जाती है।
रासायनिक संतुलन तक पहुँचने पर, स्थिर तापमान पर, आगे और पीछे की प्रतिक्रियाओं के विकास की दर समान होती है।
सबप्रत्यक्ष = सभी श्लोक में
दरें समान हैं, लेकिन सांद्रता नहीं हैं। अभिकर्मकों और उत्पादों की सांद्रता समान होने की संभावना नहीं है। केवल दुर्लभ मामलों में ही ऐसा होता है। ज्यादातर मामलों में अभिकर्मकों की एकाग्रता उत्पादों की तुलना में अधिक होगी या इसके विपरीत।
इस प्रकार, हमारे पास की विकास दर को आलेखीय रूप से निरूपित करने के तीन संभावित तरीके हैं पर अभिकारकों और उत्पादों की सांद्रता से संबंधित प्रत्यक्ष और व्युत्क्रम प्रतिक्रियाएं समय। आइए प्रत्येक मामले को देखें:
पहला मामला: समान सांद्रता:
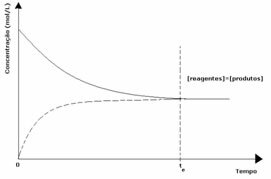
जैसा कि ग्राफ में देखा गया है, समय t. परतथा आगे और पीछे की प्रतिक्रियाएं समान होती हैं, इस मामले में अभिकारकों और उत्पादों की सांद्रता समान होती है। इस प्रकार, संतुलन किसी भी तरफ स्थानांतरित नहीं होता है, दोनों प्रतिक्रियाओं की तीव्रता समान होती है, जैसा कि नीचे व्यक्त किया गया है:
दूसरा मामला: उत्पादों की सांद्रता से अधिक अभिकर्मकों की सांद्रता:
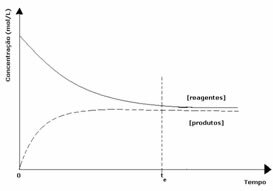
इस मामले में, यह देखा गया है कि संतुलन तक पहुँचने पर, अभिकारकों की सांद्रता उत्पादों की तुलना में अधिक होती है। इस प्रकार, यह निष्कर्ष निकाला जाता है कि यदि अधिक अभिकारक है, तो प्रतिलोम प्रतिक्रिया अधिक तीव्रता के साथ हो रही है। प्रतिक्रिया को बाईं ओर स्थानांतरित कर दिया गया है:
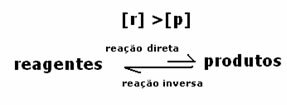
तीसरा मामला: अभिकर्मकों से अधिक उत्पादों की सांद्रता:
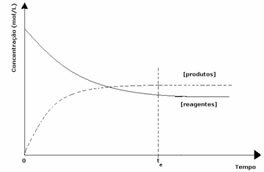
चूंकि संतुलन पर उत्पादों की सांद्रता अधिक होती है, इसका मतलब है कि प्रतिक्रिया है दाईं ओर स्थानांतरित किया गया, क्योंकि प्रत्यक्ष प्रतिक्रिया (उत्पादों के निर्माण के साथ) अधिक से अधिक होती है तीव्रता।
क्या इंगित करेगा कि प्रतिक्रिया दाईं ओर या बाईं ओर जाती है, संतुलन स्थिरांक K होगा, जो केवल तापमान पर निर्भर करता है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
ब्राजील स्कूल टीम
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm


