आयनों के बीच आयनिक बंधन होता है, जैसा कि इसके नाम से पता चलता है। चूँकि उनके पास विपरीत आवेश होते हैं, धनायन (धनात्मक आवेश वाला तत्व) और ऋणायन (ऋणात्मक आवेश वाला तत्व) एक दूसरे को इलेक्ट्रोस्टैटिक रूप से आकर्षित करते हैं, जिससे बंधन बनता है। हालाँकि, एक आयनिक ठोस का गठन धनायनों और आयनों के एक समूह द्वारा किया जाता है, जो अच्छी तरह से परिभाषित ज्यामितीय आकृतियों के साथ व्यवस्थित होते हैं, जिन्हें जाली या क्रिस्टलीय जाली कहा जाता है।
उदाहरण के लिए, सोडियम से क्लोरीन में एक इलेक्ट्रॉन के निश्चित स्थानांतरण से नमक (सोडियम क्लोराइड) बनता है, जिससे सोडियम धनायन (Na) बनता है।+) और क्लोराइड आयन (Cl .)-). व्यवहार में, इस प्रतिक्रिया में न केवल दो परमाणु शामिल होते हैं, बल्कि परमाणुओं की एक विशाल और अनिश्चित संख्या होती है जो एक घन-आकार की क्रिस्टलीय जाली बनाती है, जैसा कि नीचे दिखाया गया है:
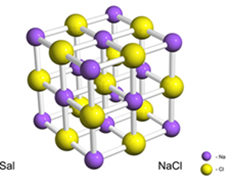
यदि हम एक स्कैनिंग इलेक्ट्रॉन माइक्रोस्कोप के साथ नमक क्रिस्टल को देखते हैं, तो हम देखेंगे कि वे वास्तव में उनकी आंतरिक संरचना के कारण घन हैं।

चूँकि प्रत्येक आयनिक यौगिक तब एक अनिश्चित और बहुत बड़ी संख्या में आयनों से बना होता है, हम एक आयनिक यौगिक का प्रतिनिधित्व कैसे कर सकते हैं?
आमतौर पर इस्तेमाल किया जाने वाला सूत्र है इकाई सूत्र, जो एक है कि क्रिस्टलीय जाली बनाने वाले धनायनों और आयनों की न्यूनतम संभव संख्या द्वारा व्यक्त अनुपात का प्रतिनिधित्व करता है, ताकि यौगिक का कुल आवेश निष्प्रभावी हो जाए. ऐसा होने के लिए यह आवश्यक है कि एक परमाणु द्वारा छोड़े गए इलेक्ट्रॉनों की संख्या दूसरे परमाणु द्वारा प्राप्त इलेक्ट्रॉनों की संख्या के बराबर हो।
आयनिक यौगिकों के इकाई सूत्र के बारे में कुछ पहलू महत्वपूर्ण हैं, कुछ देखें:
- हमेशा पहले धनायन और फिर ऋणायन लिखें;
- चूंकि प्रत्येक आयनिक यौगिक विद्युत रूप से तटस्थ होता है, व्यक्तिगत आयन आवेशों को लिखने की आवश्यकता नहीं होती है;
- प्रत्येक आयन के दाईं ओर दिखाई देने वाली सबस्क्रिप्ट संख्याएँ धनायन के परमाणुओं के आयनों के अनुपात को दर्शाती हैं। इन संख्याओं को सूचकांक कहा जाता है और संख्या 1 नहीं लिखी जाती है।
उदाहरण के लिए, सोडियम क्लोराइड के मामले में, हमारे पास इसका इकाई सूत्र NaCl है, क्योंकि हमारे पास प्रत्येक क्लोराइड आयन के लिए ठीक 1 सोडियम धनायन है।
एक और उदाहरण देखें, अली3+ पर तीन धनात्मक आवेश हैं, जबकि F- केवल एक ऋणात्मक है, इसलिए यौगिक को बेअसर करने के लिए तीन फ्लोराइड आयनों की आवश्यकता होती है। इस प्रकार, हम यह निष्कर्ष निकालते हैं कि इसका इकाई सूत्र AlF. है3.
आयनिक यौगिक के इकाई सूत्र पर पहुंचने का एक सरल तरीका इसके सूचकांकों के लिए इसके शुल्कों का आदान-प्रदान करना है, जैसा कि नीचे एक सामान्य तरीके से दिखाया गया है:
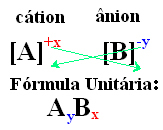
उदाहरण:

आयनिक पदार्थों का प्रतिनिधित्व करने के लिए इस्तेमाल किया जाने वाला एक अन्य सूत्र है लुईस सूत्र या इलेक्ट्रॉनिक सूत्र, क्या भ तत्व प्रतीक के चारों ओर "गेंदों" आयनों के वैलेंस शेल से इलेक्ट्रॉनों का प्रतिनिधित्व करता है। नमक के मामले में, हमारे पास है:

जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm
