विद्युत आवेशों को आकर्षित करने के लिए कनेक्शनों की क्षमता को पोलारिटी के रूप में परिभाषित किया जाता है, जो उस कनेक्शन के आधार पर एक अलग चरित्र लेता है जहां यह मौजूद है।
कार्बनिक यौगिकों से जुड़े सबसे लगातार बंधन कार्बन परमाणुओं के बीच या कार्बन और हाइड्रोजन परमाणुओं के बीच होते हैं: सी सी और सी ─ एच (हाइड्रोकार्बन)। हम इस प्रकार के बंधन को सहसंयोजक के रूप में वर्गीकृत करते हैं, यह केवल कार्बन और हाइड्रोजन द्वारा निर्मित कार्बनिक यौगिकों के सभी बंधनों में मौजूद होता है।
जब एक कार्बनिक यौगिक के अणु में कार्बन और हाइड्रोजन के अलावा कोई अन्य रासायनिक तत्व होता है, तो उसके अणुओं में एक निश्चित ध्रुवता होगी। हम इस तत्व को एक विषम परमाणु कहते हैं और यह हो सकता है: नाइट्रोजन (एन), ऑक्सीजन (ओ), दूसरों के बीच में।
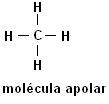
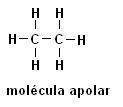
मीथेन (सीएच4) ईथेन (सी2एच6)
ध्यान दें कि दोनों संरचनाओं में हेटेरोएटम की उपस्थिति नहीं होती है, इस मामले में अणुओं को गैर-ध्रुवीय के रूप में वर्गीकृत किया जाता है।


हेटेरोएटम के रूप में ऑक्सीजन की उपस्थिति अणुओं को ध्रुवता दिखाती है। पहला अणु यौगिक इथेनॉल है (चौधरी3चौधरी2ओह), हाइड्रॉक्सिल की उपस्थिति - OH इस यौगिक को एक ध्रुवीय चरित्र देता है, भले ही इसकी संरचना में एक गैर-ध्रुवीय भाग हो।
लिरिया अल्वेस द्वारा
रसायन विज्ञान में स्नातक
ब्राजील स्कूल टीम
और देखें! समतल समावयवी
कार्बनिक रसायन विज्ञान - रसायन विज्ञान - ब्राजील स्कूल
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm


