लिखित मे "मोल / एल या मोलरिटी में एकाग्रताआपने देखा कि mol/L में सांद्रता विलेय में पदार्थ की मात्रा से संबंधित है (n .)1, mols में मापा जाता है) लीटर (V) में घोल की मात्रा के साथ। हालाँकि, कुछ विलेय ऐसे भी होते हैं, जिन्हें पानी में रखने पर आयन उत्पन्न होते हैं।
एक उदाहरण है जब हम पानी में नमक (NaCl) डालते हैं, तो Cl के साथ पानी के धनात्मक ध्रुव और Na के साथ ऋणात्मक ध्रुव के बीच आकर्षण उत्पन्न होता है, जिससे Na आयन उत्पन्न होते हैं।+ और क्लू-.
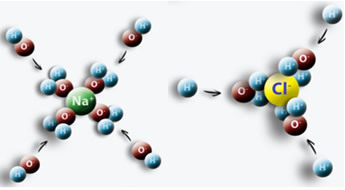
यह जानना महत्वपूर्ण है कि इन आयनों के mol/L में सांद्रता का निर्धारण कैसे किया जाता है, क्योंकि यह कई स्थितियों में उपयोगी हो सकता है। इसका उपयोग करने वाला एक क्षेत्र दवा है, विशेष रूप से चिकित्सा रक्त परीक्षण में। हमारे रक्त और अन्य शारीरिक तरल पदार्थों में आयन घुल जाते हैं। यदि हमारे रक्त में इन आयनों की सांद्रता सामान्य से ऊपर या नीचे है, तो यह हमारे शरीर के समुचित कार्य से समझौता कर सकता है और विकारों और बीमारियों को जन्म दे सकता है।
लौह आयनों का मामला देखें (Fe2+) यदि व्यक्ति में इस आयन की कमी है, तो उसे एनीमिया हो सकता है। इस प्रकार, जब एनीमिया वाले किसी व्यक्ति को बताया जाता है कि उन्हें आयरन युक्त खाद्य पदार्थ या यहां तक कि आयरन युक्त किसी दवा का सेवन करने की आवश्यकता है, तो यह वास्तव में आयरन आयन है न कि धातु तत्व।
एक अन्य मामला तब होता है जब कैल्शियम आयनों का नुकसान होता है (Ca .)2+) हड्डियों में, ऑस्टियोपोरोसिस का कारण बनता है, जैसा कि नीचे हड्डियों की बढ़ी हुई छवियों के साथ तस्वीरों में दिखाया गया है:

आयनों के अन्य उदाहरण देखें जो हमारे शरीर में महत्वपूर्ण कार्य करते हैं और सही एकाग्रता में होने की आवश्यकता होती है:

इसलिए, इस जानकारी को देखते हुए, यह स्पष्ट हो जाता है कि समाधान में आयनों की एकाग्रता की गणना करना जानना वास्तव में महत्वपूर्ण है। लेकिन यह कैसे किया जा सकता है?
समाधान में मौजूद आयनों के mol/L में सांद्रता निर्धारित करना संभव है यदि दो आवश्यक डेटा ज्ञात हैं, जो हैं:
- पानी में घुले पदार्थों के सूत्र;
- आपके समाधानों की मोलरता।
हाथ में इन आंकड़ों के साथ, प्रश्न में विलेय के पृथक्करण या आयनीकरण समीकरण को लिखें और आयनों की एकाग्रता को घटाकर खोजें, जैसा कि यह प्रत्येक आयन के मोलों की संख्या के समानुपाती होता है। इसका अर्थ है कि आयनों की सांद्रता आयनीकरण या वियोजन समीकरण में उनके संबंधित गुणांकों के समानुपाती होती है।
यह गणना कैसे की जाती है, इसे बेहतर ढंग से समझने के लिए निम्न उदाहरण देखें:
"विचार करें कि मैग्नीशियम फॉस्फेट (Mg .) के दिए गए जलीय घोल के पदार्थ की मात्रा में सांद्रता3(धूल4)2 0.5 मोल/लीटर है। मैग्नीशियम धनायनों के mol/L में सांद्रता क्या होगी (Mg What)2+(यहां)) और फॉस्फेट आयनों (पीओ .)3-4(एक्यू)) इस समाधान में, यह देखते हुए कि हदबंदी की डिग्री (α) १००% थी?"
इस समस्या को हल करने में पहला कदम पृथक्करण या आयनीकरण समीकरण लिखना है। यदि आपको कठिनाई होती है, तो आप नीचे दिए गए सामान्य समीकरण पर आधारित हो सकते हैं:
1 एएक्सखआप → एक्स ए+y + वाई बी-एक्स
1 मोल x mol y mol
तो, इस उदाहरण पर विचार करते हुए कि मैग्नीशियम फॉस्फेट पूरी तरह से अलग हो गया है, हमारे पास निम्नलिखित समीकरण है:
1 मिलीग्राम3(धूल4)2(एक्यू) → 3 मिलीग्राम2+(यहां) + 2 जीपी3-4(एक्यू)
1 मोल 3 मोल 2 मोल
हम देख सकते हैं कि Mg. का 1 मोल3(धूल4)2 3 mol Mg. देता है2+(यहां) और 2 mol PO3-4(एक्यू); इस प्रकार, धनायन के मोल की संख्या फॉस्फेट के मोल की संख्या से 3 गुना होगी जिसके साथ समाधान तैयार किया गया था, और आयनों की संख्या 2 गुना होगी।
चूंकि विलयन Mg. का 0.5 mol/L है3(धूल4)2(एक्यू) , इसका मतलब है कि 0.5 मिलीग्राम मिलीग्राम इसके 1 एल में भंग कर दिया गया था3(धूल4)2, जिसने Mg. के 1.5 mol/L को जन्म दिया2+(यहां) और पीओ. का 1.0 mol/L3-4(एक्यू):
1 मिलीग्राम3(धूल4)2(एक्यू) → 3 मिलीग्राम2+(यहां) + 2 जीपी3-4(एक्यू)
1 मोल 3 मोल 2 मोल
0.5 मोल x y x
1. 0,5 3. 0,5 2. 0,5
0.5 मोल / एल १.५ मोल/ली१.० मोल/ली
लेकिन क्या होगा अगर पृथक्करण या आयनीकरण की डिग्री 100% नहीं थी? मान लीजिए कि यह 70% था, हम इन आयनों की mol/L सांद्रता का पता कैसे लगाएंगे?
उस स्थिति में, बस तीन का एक साधारण नियम निष्पादित करें। निचे देखो:
1.5 mol/L Mg2+(यहां) 100 %
x ७०%
एक्स = 70. 1,5 → x = 1.05 mol/L Mg आयन2+(यहां)
100
पीओ. का 1.5 mol/L3-4(एक्यू) 100 %
वाई 70%
वाई = 70. 1,0 → y = 0.70 mol/L PO आयनों का3-4(एक्यू)
100
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm


