एन्थैल्पी (एच) इसे प्रत्येक सामग्री की ऊर्जा सामग्री या किसी सिस्टम की समग्र ऊर्जा के रूप में परिभाषित किया जा सकता है। हालांकि, व्यवहार में, किसी पदार्थ की एन्थैल्पी का निर्धारण करना संभव नहीं है। तो, जो आमतौर पर मापा जाता है वह है एन्थैल्पी भिन्नता 

हम यहां एक्ज़ोथिर्मिक प्रतिक्रियाओं में थैलेपी की भिन्नता का विश्लेषण करेंगे (शब्द "एक्सो" ग्रीक से आया है और इसका अर्थ है "बाहर, बाहर, बाहर"), जो वे प्रतिक्रियाएं हैं जिनमें गर्मी रिलीज होती है। रोजमर्रा की जिंदगी में, इन प्रतिक्रियाओं के कई उदाहरण हैं, जैसे दहन और पानी के साथ बुझा हुआ चूना का मिश्रण।
इन मामलों में, थैलेपी भिन्नता 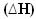 अंतिम एन्थैल्पी माइनस प्रारंभिक एन्थैल्पी (Hएफ - होमैं) या, जैसा कि यह एक प्रतिक्रिया है, उत्पादों का थैलेपी मान घटाकर अभिकारकों (H .) का होता हैपी - होआर).
अंतिम एन्थैल्पी माइनस प्रारंभिक एन्थैल्पी (Hएफ - होमैं) या, जैसा कि यह एक प्रतिक्रिया है, उत्पादों का थैलेपी मान घटाकर अभिकारकों (H .) का होता हैपी - होआर).
जैसे ही गर्मी निकलती है, ऊर्जा खो जाती है। इस प्रकार, निकाय की कुल ऊर्जा कम हो जाती है, जिससे उत्पादों की एन्थैल्पी हमेशा से कम रहती है अभिकर्मकों की, इसलिए एक्ज़ोथिर्मिक प्रतिक्रियाओं में थैलेपी भिन्नता हमेशा नकारात्मक होगी, कम से कम शून्य 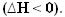
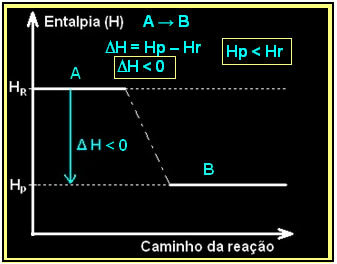
एक सामान्य एक्ज़ोथिर्मिक प्रतिक्रिया को ध्यान में रखते हुए:
| ए → बी + गर्मी |
इसे नीचे दिए गए की तरह एक थैलेपी आरेख का उपयोग करके व्यक्त किया जा सकता है:
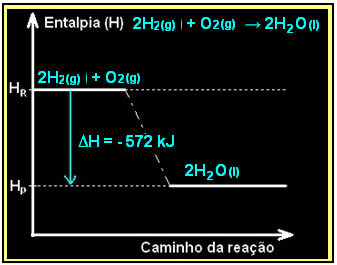
तरल पानी के निर्माण के साथ हाइड्रोजन गैस का दहन ऊर्जा के निकलने के साथ होता है। इस अभिक्रिया में निकाय की एन्थैल्पी भिन्नता का मान निम्न द्वारा दिया जाता है:
2 एच2(जी) + ओ2(जी) → 2H2हे(1)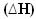 = - ५७२ केजे
= - ५७२ केजे
आपका आरेख इस प्रकार दर्शाया जाएगा:
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm
