रेडॉक्स प्रतिक्रियाओं की मुख्य विशिष्ट विशेषता यह है कि एक साथ एक रासायनिक प्रजाति इलेक्ट्रॉनों को खो देती है (ऑक्सीकरण द्वारा) और दूसरी इलेक्ट्रॉनों को प्राप्त करती है (कम करके)।
हालांकि, कुछ प्रतिक्रियाओं में यह देखना संभव है कि केवल ऑक्सीकरण और/या कमी नहीं है। नीचे एक उदाहरण है:
एसएनएस + एचसीएल + एचएनओ3 → SnCl4 + एस + नहीं + एच2हे
इस प्रतिक्रिया में सभी परमाणुओं के ऑक्सीकरण संख्या (एनओएक्स) की गणना, जैसा कि "ऑक्सीकरण संख्या (एनओएक्स) का निर्धारण" पाठ में पढ़ाया गया है, हमारे पास है:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
एसएनएस + एचसीएल + एचएनओ3 → SnCl4 + एस + नहीं + एच2हे
आइए अब देखें कि कौन सेपदार्थों को उनके Nox में भिन्नता का सामना करना पड़ा और, परिणामस्वरूप, जो ऑक्सीकृत और कम हो गए:
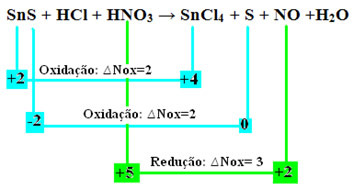
ध्यान दें कि दो ऑक्सीकरण हुए हैं। तो, उस स्थिति में, रासायनिक समीकरण को कैसे संतुलित किया जाए?
ध्यान में रखने वाली एक महत्वपूर्ण बात यह है कि सभी रेडॉक्स प्रतिक्रियाओं पर लागू होता है कि दिए गए इलेक्ट्रॉनों की संख्या हमेशा प्राप्त इलेक्ट्रॉनों की संख्या के बराबर होनी चाहिए।
इसलिए, इस प्रकार की प्रतिक्रिया को संतुलित करने के लिए, पाठ में स्थापित समान नियमों का पालन करें "
रेडॉक्स संतुलन”, हालांकि, केवल एक परिवर्तन के साथ: दो ऑक्सीकरण (SnS) उत्पन्न करने वाली प्रजातियों के Nox भिन्नता (∆Nox) का निर्धारण दो Nox का योग होगा, जो हमें खोए हुए इलेक्ट्रॉनों का कुल मूल्य देगा:- SnS: कुल Nox = (∆Nox SnCl .)4) + (∆नॉक्स एस)
एसएनएस: कुल एनओएक्स = 2 + 2 = 4
- एचएनओ3: नॉक्स = 3
तो, हम संतुलन के लिए निम्नलिखित चरणों के साथ आगे बढ़ सकते हैं:
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
- एसएनएस: ∆कुल एनओएक्स = 4 → 4 एचएनओ गुणांक होगा3;
- एचएनओ3: नॉक्स = 3 → 3 SnS का गुणांक होगा।
3 एसएनएस + एचसीएल + 4 एचएनओ3 → SnCl4 + एस + नहीं + एच2हे
परीक्षण विधि द्वारा संतुलन जारी रखना:
- चूँकि आपके पास पहले सदस्य में 3 एसएन और 3 एस हैं, ये दूसरे सदस्य में आपके गुणांक भी होंगे:
3 एसएनएस + एचसीएल + 4 एचएनओ3 → 3 SnCl4 + 3 वाई+नहीं+एच2हे
- इसके साथ, दूसरे सदस्य के पास 12 Cl (3. 4 = 12), तो 12 उस पदार्थ का गुणांक होगा जिसमें पहले सदस्य में Cl पाया जाता है, जो कि HCl है:
3 एसएनएस + 12 एचसीएल + 4 एचएनओ3 → 3 SnCl4 + 3 एस + नहीं + एच2हे
- अब हमारे पास पहले सदस्य (12 + 4 = 16) में 16 एच है, इसलिए एच का गुणांक है2O 8 के बराबर होगा, क्योंकि 8 को हाइड्रोजन इंडेक्स से गुणा किया जाता है, जो कि 2 है, 16 देता है:
3 एसएनएस + 12 एचसीएल + 4 एचएनओ3 → 3 SnCl4 + 3 एस + नहीं +8एच2हे
- इसके अलावा, पहले सदस्य में भी 4 N है, इसलिए 4 भी दूसरे सदस्य में N का गुणांक होगा:
3 एसएनएस + 12 एचसीएल + 4 एचएनओ3 → 3 SnCl4 + 3 एस + 4 नहीं +8 एच2हे
ध्यान दें कि पहले अंग में ऑक्सीजन की मात्रा (3. 4 = 12) दूसरे अंग (4 + 8 = 12) में उस तत्व की कुल मात्रा के बराबर है। तो प्रतिक्रिया संतुलित है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? नज़र:
FOGAÇA, जेनिफर रोचा वर्गास। "एक से अधिक ऑक्सीकरण और/या कमी के साथ प्रतिक्रियाएं"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. 27 जुलाई, 2021 को एक्सेस किया गया।