भागसुनवाई एक प्रयोगशाला, औद्योगिक या घरेलू प्रक्रिया है जिसमें एक निश्चित मात्रा विलायक (शुद्ध) पहले से मौजूद समाधान से जोड़ा या हटाया जाता है (वाष्पीकरण के माध्यम से)।
किसी भी घोल में हमेशा एक विलायक और कम से कम एक विलेय की उपस्थिति होती है, जैसे कि 500 एमएल पानी और 10 ग्राम पानी के मिश्रण में। सोडियम क्लोराइड (NaCl) नीचे दर्शाया गया है:
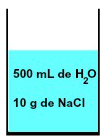
पानी और सोडियम क्लोराइड द्वारा बने मिश्रण का प्रतिनिधित्व
यदि इस घोल में 300 mL पानी मिला दिया जाए, तो यह प्रक्रिया कहलाती है पतला करने की क्रिया, जैसे-जैसे घोल का आयतन बढ़ता है - इस मामले में, 800 mL तक - हालांकि, विलेय की मात्रा को बदले बिना।

लवणीय विलयन में विलायक मिलाने से तनुकरण
पतला करने की क्रिया यह इस खारा समाधान (500 एमएल पानी और 10 ग्राम NaCl से बना) को गर्म करके भी किया जा सकता है, उदाहरण के लिए, 300 एमएल पानी वाष्पीकृत. इस मामले में, समाधान की मात्रा कम हो जाएगी, हालांकि, विलेय की मात्रा नहीं बदली जाएगी।

लवणीय विलयन में विलायक वाष्पीकरण द्वारा तनुकरण
कमजोर पड़ने के सिद्धांत:
घोल का अंतिम आयतन, जब विलायक जोड़ा जाता है, हमेशा प्रारंभिक मात्रा से अधिक होता है;
घोल का अंतिम आयतन, जब विलायक को हटा दिया जाता है, हमेशा प्रारंभिक मात्रा से छोटा होता है;
घोल को पतला करते समय विलेय का द्रव्यमान कभी नहीं बदलता है;
घोल को पतला करने पर विलेय की मोल संख्या कभी नहीं बदलती;
जब तनुकरण में विलायक मिलाया जाता है, तो अंतिम विलयन की सांद्रता हमेशा प्रारंभिक विलयन की सांद्रता से कम होती है;
जब विलायक को तनुकरण में हटा दिया जाता है, तो अंतिम विलयन की सांद्रता हमेशा प्रारंभिक विलयन की सांद्रता से अधिक होती है।
तनुकरण में प्रयुक्त सूत्र
समाधान के अंतिम आयतन की गणना:
तनुकरण में अंतिम विलयन का आयतन जिसमें विलायक मिलाया जाता है, निम्नलिखित व्यंजक द्वारा परिकलित किया जाता है:
वीएफ = वीमैं + वी
वीएफ = अंतिम विलयन का आयतन
वीमैं = प्रारंभिक विलयन का आयतन
वी= जोड़ा गया विलायक का आयतन
यदि तनुकरण में विलायक को हटाया जाता है, तो अंतिम आयतन की गणना निम्नलिखित व्यंजक द्वारा की जाएगी:
वीएफ = वीमैं - वीतथा
वीतथा = वाष्पित विलायक का आयतन।
की गणना सामान्य एकाग्रता:
तनुकरण के बाद अंतिम विलयन की सांद्रता की गणना निम्नानुसार की जा सकती है:
सीमैं.वीमैं = सीएफ.वीएफ
सीमैं= प्रारंभिक विलयन की सामान्य सान्द्रता
वीमैं = प्रारंभिक विलयन का आयतन
सीएफ = अंतिम विलयन के mol/L में मोलरता या सान्द्रता
वीएफ= अंतिम विलयन का आयतन
की गणना mol/L. में दाढ़ या सांद्रता:
तनुकरण के बाद अंतिम विलयन की मोलरता की गणना निम्नलिखित व्यंजक द्वारा की जा सकती है:
ममैं.वीमैं = एमएफ.वीएफ
ममैं= प्रारंभिक विलयन के mol/L में मोलरता या सान्द्रता
वीमैं = प्रारंभिक विलयन का आयतन
मएफ = अंतिम विलयन के mol/L में मोलरता या सान्द्रता
वीएफ= अंतिम विलयन का आयतन
थोक शीर्षक गणना:
अंतिम समाधान के शीर्षक, एक कमजोर पड़ने के बाद, निम्नलिखित अभिव्यक्ति द्वारा गणना की जा सकती है:
टीमैं।ममैं = टीएफ।मएफ
टीमैं= प्रारंभिक समाधान का शीर्षक
ममैं = प्रारंभिक विलयन का द्रव्यमान
टीएफ = अंतिम समाधान का शीर्षक
मएफ= अंतिम विलयन का द्रव्यमान
जैसा कि शीर्षक की गणना प्रतिशत के रूप में भी की जा सकती है और जलीय घोलों में, द्रव्यमान का मान आयतन के समान होता है, हम निम्नलिखित गणितीय अभिव्यक्ति का उपयोग कर सकते हैं:
पीमैं.वीमैं = पीएफ.वीएफ
पीमैं= प्रारंभिक समाधान का प्रतिशत
वीमैं = प्रारंभिक विलयन का आयतन
पीएफ = अंतिम समाधान का प्रतिशत
वीएफ= अंतिम विलयन का आयतन
तनुकरण में की गई गणनाओं के उदाहरण:
पहला उदाहरण - (यूएफबीए) ८% सोडियम बाइकार्बोनेट घोल के १०० एमएल में ३०० एमएल पानी मिलाने से प्राप्त घोल की सांद्रता है:
ए) 24% बी) 18% सी) 9% डी) 4% ई) 2%
अभ्यास द्वारा प्रदान किया गया डेटा:
प्रारंभिक समाधान का प्रतिशत (पीमैं) = 8%
प्रारंभिक समाधान मात्रा (वीमैं) = १०० एमएल
अंतिम समाधान मात्रा (वीएफ) = ४०० एमएल (३०० एमएल से १०० एमएल तक मिश्रण का परिणाम)
अंतिम समाधान का प्रतिशत (पीएफ) = ?
समाधान की प्रतिशत एकाग्रता की गणना करने के लिए, हम निम्नलिखित अभिव्यक्ति में दिए गए इन मानों का उपयोग कर सकते हैं:
पीमैं.वीमैं = पीएफ.वीएफ
८,१०० = पीएफ.400
८०० = पीएफ.400
पीएफ = 800
400
पीएफ = 2%
दूसरा उदाहरण - (यूएफपीए) 200 एमएल मैग्नीशियम हाइड्रॉक्साइड घोल, एमजी (ओएच)2, 2.9 ग्राम बेस को पानी में घोलकर तैयार किया गया था। 0.125 M के बराबर मोलरिटी वाला घोल प्राप्त करने के लिए इस घोल की कितनी मात्रा को 300 mL तक पतला किया जाना चाहिए? डेटा: एच = 1; एमजी = 24; ओ = 16.
ए) 450 एमएल बी) 150 एमएल सी) 400 एमएल डी) 300 एमएल ई) 900 एमएल
अभ्यास द्वारा प्रदान किया गया डेटा:
प्रारंभिक विलयन में विलेय का द्रव्यमान (m .)1) = 2.9 ग्राम
तनुकरण के लिए उपयोग किए जाने वाले विलयन का आयतन = २०० mL या ०.२ L (१००० से विभाजित करने के बाद)
प्रारंभिक समाधान मात्रा (वीमैं) जो पतला होगा = ?
अंतिम समाधान मात्रा (वीएफ) = ३०० एमएल
अंतिम विलयन के mol/L में मोलरता या सांद्रता (M ()एफ) = 0.125M
समाधान के प्रतिशत के रूप में एकाग्रता की गणना करने के लिए, हमें निम्नलिखित कार्य करने होंगे:
चरण 1: विलेय के दाढ़ द्रव्यमान की गणना करें।
इसके लिए, हमें प्रत्येक तत्व के परमाणुओं की संख्या को उसके संबंधित परमाणु द्रव्यमान से गुणा करना होगा और फिर परिणाम जोड़ना होगा:
ममिलीग्राम (ओएच) 2 = 1.24 + 2.16 + 2.1
ममिलीग्राम (ओएच) 2 = 24 + 32 + 2
ममिलीग्राम (ओएच) 2 = 58 ग्राम/मोल
चरण दो: प्रारंभिक समाधान की मोल/एल या मोलरिटी में एकाग्रता की गणना करें:
ममैं = म1
एमवी
ममैं = 2,9
58.0,2
ममैं = 2,9
11,6
ममैं =0.25 mol/L
चरण 3: समाधान की मात्रा निर्धारित करें जो निम्नलिखित अभिव्यक्ति में प्रदान किए गए और पाए गए मानों का उपयोग करके पतला होगा:
ममैं.वीमैं = एमएफ.वीएफ
0.25.वीमैं = 0,125.300
0.25.वीमैं = 37,5
वीमैं = 37,5
0,25
वीमैं = १५० मिली
तीसरा उदाहरण - (यूईजी-जीओ) मान लें कि कॉपर सल्फेट के जलीय घोल का १०० एमएल, जिसकी सांद्रता ४० ग्राम के बराबर है। ली–1, 400 मिलीलीटर आसुत जल जोड़ा गया। इस मामले में, नए समाधान के प्रत्येक एमएल का द्रव्यमान मिलीग्राम में होगा, इसके बराबर:
ए) 2 बी) 4 सी) 8 डी) 10
अभ्यास द्वारा प्रदान किया गया डेटा:
तनुकरण में मिलाए गए पानी का आयतन = ४०० mL
प्रारंभिक समाधान मात्रा (वीमैं) = १०० एमएल
अंतिम समाधान मात्रा (वीएफ) = ५०० एमएल (४०० एमएल से १०० एमएल तक मिश्रण का परिणाम)
प्रारंभिक समाधान की सामान्य एकाग्रता (सीमैं) = ४० ग्रा. ली–1
अंतिम समाधान की सामान्य एकाग्रता (सीएफ) मिलीग्राम/एमएल में = ?
मिलीग्राम/एमएल में समाधान एकाग्रता की गणना करने के लिए, हमें निम्न कार्य करना चाहिए:
चरण 1: प्रारंभिक समाधान एकाग्रता को g/L से mg/mL में बदलें।
ऐसा करने के लिए, हमें अंश और हर दोनों को 1000 से गुणा करना होगा और दी गई एकाग्रता को 1000 से विभाजित करना होगा:
सीमैं = ४० ग्राम १०००
1एल. 1000
सीमैं = ४० मिलीग्राम/एमएल
इसलिए, इकाइयाँ g/L और mg/mL समान हैं।
चरण दो: निम्नलिखित अभिव्यक्ति में दिए गए मानों का उपयोग करके मिलीग्राम/एमएल में एकाग्रता की गणना करें:
सीमैं.वीमैं = सीएफ.वीएफ
४०,१०० = सीएफ.500
4000 = सीएफ.500
सीएफ = 4000
500
सीएफ = 8 मिलीग्राम/एमएल
मेरे द्वारा। डिओगो लोपेज डायस
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diluicao.htm

