गैस परिवर्तन ऐसी प्रक्रियाएं हैं जिनमें a गैस इसके एक या अधिक पैरामीटर हो सकते हैं दबाव, आयतन तथा तापमानबदला हुआ. विशेष गैसीय परिवर्तन होते हैं जिनमें इनमें से कम से कम एक मात्रा को स्थिर रखा जाता है।
गैस रूपांतरण के प्रकार हैं:
समदाब रेखीय परिवर्तन;
इज़ोटेर्मल परिवर्तन;
आइसोवोल्यूमेट्रिक परिवर्तन;
रुद्धोष्म परिवर्तन।
यह भी देखें:थर्मोलॉजी - गर्मी और तापमान से जुड़ी घटनाओं का अध्ययन
समतापी परिवर्तन
इज़ोटेर्मल परिवर्तन वह है जिसमें गैस का तापमान स्थिर रहता है। इस प्रकार के परिवर्तन में, दबाव और मात्रा हैंव्युत्क्रमानुपातीआनुपातिक, ताकि को बढ़ाकर दबाव, मात्रा कम हो जाती है और इसके विपरीत।
इज़ोटेर्मल परिवर्तनों का वर्णन द्वारा किया गया है लीहे बॉयल-मैरियट. इस नियम के अनुसार, एक आदर्श गैस के दबाव और आयतन के बीच का गुणनफल स्थिर होता है:

के लियेमैं तथा के लियेएफ - प्रारंभिक और अंतिम दबाव
वीमैं तथा वीएफ - प्रारंभिक और अंतिम गति
क - लगातार
समदाब रेखीय परिवर्तन
समदाब रेखीय परिवर्तन की विशेषता है a मात्रा भिन्नता और तापमान, दबाव स्थिर रखते हुए। इस प्रकार के परिवर्तन को गणितीय रूप से के कानून द्वारा वर्णित किया गया है
चार्ल्स और गे-लुसाकी. एक समदाब रेखीय परिवर्तन के दौरान, तापमान और आयतन सीधे आनुपातिक होते हैं, अर्थात रखते हुए गैस का दाब स्थिर रहने पर गैस के ताप में वृद्धि के साथ उसके द्वारा ग्रहण किए गए आयतन में वृद्धि होगी। गैस।द्वारा प्रयुक्त सूत्र देखें गे-लुसाक कानून:
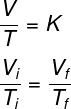
टीमैं तथा टीएफ - प्रारंभिक और अंतिम तापमान
के अनुसार गे-लुसाक का नियमएक समदाब रेखीय परिवर्तन के दौरान गैस के आयतन और दबाव के बीच का अनुपात एक स्थिरांक के बराबर होता है।
आइसोवोल्यूमेट्रिक परिवर्तन
आइसोवोल्यूमेट्रिक, आइसोमेट्रिक या आइसोकोरिक परिवर्तन उस प्रक्रिया का नाम है जिसमें एक आदर्श गैस दबाव और तापमान में परिवर्तन से गुजरती है, खुद को बनाए रखती है लगातार आपका आयतन। इस प्रकार का गैस परिवर्तन, जो कठोर दीवारों वाले कंटेनरों के अंदर होता है, गणितीय रूप से परिभाषित किया गया है चार्ल्स का नियम.
इस नियम के अनुसार एक आदर्श गैस के दाब तथा ताप का अनुपात सदैव स्थिर रहता है। इसके अलावा, इस प्रकार के परिवर्तन में, दबाव और तापमान हैं सीधे आनुपातिक: दबाव को दोगुना करते हुए, हम तापमान को दोगुना करते हैं और इसके विपरीत।
आइसोवोल्यूमेट्रिक परिवर्तनों के दौरान आदर्श गैसों के व्यवहार का वर्णन करने वाला सूत्र इस प्रकार है:
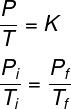
यह भी पढ़ें: ऊष्मप्रवैगिकी - भौतिकी का एक क्षेत्र जो उन घटनाओं का अध्ययन करता है जिनमें ऊष्मा विनिमय होता है
रुद्धोष्म परिवर्तन
रुद्धोष्म परिवर्तन उस प्रक्रिया का नाम है, जो a. द्वारा की गई है गैस जो नहीं बदलती तपिश बाहरी वातावरण के साथ या इसके कंटेनर की दीवारों के साथ. वह सूत्र जो गणितीय रूप से एक आदर्श गैस के व्यवहार की व्याख्या करता है, जो एक रुद्धोष्म परिवर्तन से गुजरता है, यह बताता है कि दबाव और आयतन के बीच का उत्पाद स्थिर हो जाता है γ स्थिर है।

स्थिरांक पर निर्भर करता है डिग्रीमेंआजादी गैस की, अर्थात्, दिशाओं की संख्या जिसमें गैस के अणु गति कर सकते हैं। इसकी गणना के बीच के अनुपात से भी की जा सकती है विशिष्ट ऊष्मा में दबावलगातार तथा तपिशविशिष्ट में आयतनलगातार।
गैस परिवर्तन के उदाहरण
समतापी परिवर्तन - स्थिर तापमान पर होने वाली गैस का धीमा विस्तार या संकुचन।
समदाब रेखीय परिवर्तन - एक रेफ्रिजरेटर में ठंडा करने के लिए रखे मूत्राशय में निहित गैस को ठंडा करना।
आइसोवोल्यूमेट्रिक परिवर्तन - प्रेशर कुकर में बंद जलवाष्प को पूरी तरह गर्म करें।
रुद्धोष्म परिवर्तन - एरोसोल स्प्रे द्वारा गैस को बाहर निकाला जा रहा है।

यह भी देखें: कैलोरीमेट्री - सूत्र, अवधारणाएं और हल किए गए अभ्यास
गैस परिवर्तन पर हल किए गए अभ्यास
प्रश्न 1 - नीचे दिए गए विकल्पों की समीक्षा करें और उस उत्तर की जांच करें जिसमें केवल सही विकल्प हों।
I - समतापीय परिवर्तन वे हैं जिनमें गैस का तापमान स्थिर रखा जाता है।
II - रुद्धोष्म परिवर्तनों में गैस और बाहरी वातावरण के बीच ऊष्मा विनिमय शामिल होता है।
III - आइसोकोरिक परिवर्तन वह है जिसमें गैस का दबाव स्थिर रखा जाता है।
IV - समदाब रेखीय परिवर्तन निरंतर दबाव के साथ होते हैं।
सही हैं:
ए) मैं और द्वितीय।
बी) मैं, द्वितीय और तृतीय।
ग) द्वितीय और तृतीय।
घ) मैं और चतुर्थ।
संकल्प:
विकल्प II और III गलत हैं, क्योंकि रुद्धोष्म परिवर्तनों में ऊष्मा विनिमय शामिल नहीं होता है, और समद्विबाहु परिवर्तन वे होते हैं जो स्थिर मात्रा में होते हैं। अत: सही विकल्प है पत्र डी.
प्रश्न 2 -एक आदर्श गैस में तेजी से परिवर्तन होता है, जिससे उसका तापमान, दबाव और आयतन थोड़े समय में अचानक बदल जाता है। गैस परिवर्तन के उनके ज्ञान के अनुसार, गैस द्वारा किया गया परिवर्तन था:
ए) इज़ोटेर्मल।
बी) आइसोबैरिक।
ग) रुद्धोष्म।
डी) आइसोवोल्यूमेट्रिक।
संकल्प:
रुद्धोष्म परिवर्तन जल्दी होता है, इसलिए गैस के लिए बाहरी वातावरण के साथ ऊष्मा का आदान-प्रदान करने का समय नहीं होता है। इस प्रकार के परिवर्तन में, दबाव, आयतन और तापमान पैरामीटर अचानक बदल जाते हैं। अत: सही विकल्प है पत्र सी
राफेल हेलरब्रॉक द्वारा
भौतिक विज्ञान के अध्यापक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/transformacoes-gasosas.htm

