हेस का नियम स्विस रसायनज्ञ जर्मेन एच। हेस (1802-1850), जिन्हें थर्मोकैमिस्ट्री के संस्थापकों में से एक माना जाता है। उनके कानून ने कहा:

यही है, ΔH केवल अभिकर्मकों और उत्पादों के थैलेपी मूल्यों पर निर्भर करता है, जैसा कि अभिव्यक्ति में है:
| एच = एचअभिकर्मकों + Hउत्पादों |
उदाहरण के लिए, उस प्रतिक्रिया पर विचार करें जहां 1 mol पानी (H .)2O) गैसीय अवस्था में जल में परिवर्तित हो जाता है। यह प्रतिक्रिया दो बार की जाती है; हालाँकि, हमने अलग-अलग रास्ते चुने:
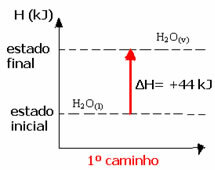
(१) यह एक ही चरण में किया गया था:
एच2हे(1) → एच2हे(वी) H= +44 kJ
(२) यह दो चरणों में किया गया:
पहला चरण: एच2हे(1) → एच2(जी) + ½ थी2 (जी) H= +286 kJ
दूसरा चरण: एच2(जी) + ½ थी2 (जी) → एच2हे(वी) H= -242 kJ
एच2हे(1) → एच2हे(वी) H= +44 kJ
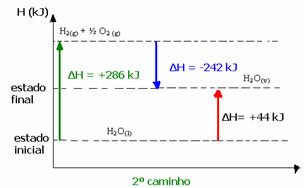
ध्यान दें कि चाहे एक या दो चरणों का प्रदर्शन किया गया हो, एन्थैल्पी परिवर्तन (ΔH) हमेशा ४४ kJ होता है। इसका कारण यह है कि ΔH प्रक्रिया को बनाने वाले चरणों के valoresH मानों का बीजगणितीय योग है, जो कि मध्यवर्ती प्रक्रियाओं का है:
| एच = एच1 + H2 + H3 + ... |
उदाहरण के लिए, दूसरे मामले में, प्रतिक्रिया का कुल H दूसरे चरण (ΔH= -242 kJ) के साथ पहले चरण (H= +286 kJ) के ΔH का योग था। इस प्रकार, हमने एक ही चरण के साथ समान प्रतिक्रिया मान प्राप्त किया:
H = (+286 + (-242)) kJ
एच = (+286 -242) केजे
एच = +44 केजे
इसलिए, हम केवल प्रारंभिक और अंतिम मूल्यों में रुचि रखते हैं। इस मामले में, प्रारंभिक अवस्था H. से मेल खाती है2हे(1) और H का अंत2हे(वी).
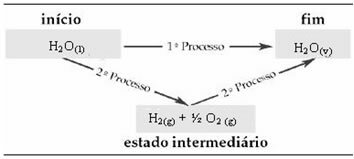
थर्मोकैमिस्ट्री में यह कानून बहुत महत्वपूर्ण हो गया है, क्योंकि कुछ रासायनिक प्रतिक्रियाओं में प्रयोगात्मक रूप से ΔH निर्धारित नहीं किया जा सकता है। तथापि, हेस के नियम के अनुसार इस प्रकार की अभिक्रिया की एन्थैल्पी की गणना अन्य अभिक्रियाओं (मध्यवर्ती अभिक्रियाओं) की एन्थैल्पी से की जा सकती है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
ब्राजील स्कूल टीम

