परमाणु पदार्थ की मौलिक इकाई है और रासायनिक तत्व की पहचान करने में सक्षम सबसे छोटा अंश है, क्योंकि यह अपनी पहचान रखता है। परमाणु शब्द ग्रीक से लिया गया है और इसका अर्थ है अविभाज्य।
इसमें एक नाभिक होता है, जिसमें न्यूट्रॉन और प्रोटॉन होते हैं, और इलेक्ट्रॉन जो नाभिक को घेरते हैं।
परमाणु संरचना
परमाणु छोटे-छोटे कणों से बना होता है, जिन्हें भी कहते हैं उप - परमाण्विक कणs: इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन।
परमाणु का अधिकांश द्रव्यमान नाभिक, एक छोटे, घने क्षेत्र में केंद्रित होता है। इसका सबसे बड़ा आयतन इलेक्ट्रोस्फीयर में पाया जाता है, जो रिक्त स्थान का स्थान है, क्योंकि इलेक्ट्रॉन नाभिक के चारों ओर परिक्रमा करते हैं।

इलेक्ट्रॉनों
हे इलेक्ट्रॉन 9.11 x 10. के मान के रूप में इसका ऋणात्मक विद्युत आवेश (-1) और लगभग कोई द्रव्यमान नहीं है-28 जी और कोर द्रव्यमान से लगभग 1840 गुना छोटा है। वे छोटे कण होते हैं जो परमाणु नाभिक के चारों ओर बहुत तेजी से घूमते हैं।
परमाणु के सबसे बाहरी क्षेत्रों में पाए जाने वाले इलेक्ट्रॉन रासायनिक बंधों के निर्माण के लिए जिम्मेदार होते हैं, जो इलेक्ट्रॉनों के दान, ग्रहण या साझा करने के माध्यम से होते हैं।
प्रोटान
हे प्रोटोन इसका धनात्मक विद्युत आवेश (+1) उसी निरपेक्ष मान का होता है जो इलेक्ट्रॉनों पर आवेश के बराबर होता है। इस तरह, एक प्रोटॉन और एक इलेक्ट्रॉन एक दूसरे को विद्युत रूप से आकर्षित करते हैं।
प्रोटॉन के माध्यम से रासायनिक तत्वों में अंतर करना संभव है, क्योंकि किसी तत्व के प्रत्येक परमाणु के नाभिक में प्रोटॉन की एक निश्चित संख्या होती है, जिसे कहा जाता है परमाणु क्रमांक.
न्यूट्रॉन
हे न्यूट्रॉन इसका कोई चार्ज नहीं है, यानी यह विद्युत रूप से तटस्थ है। प्रोटॉन के साथ मिलकर, यह परमाणु नाभिक बनाता है, जो परमाणु के पूरे द्रव्यमान (99.9%) को वहन करता है। प्रोटॉन और न्यूट्रॉन दोनों का द्रव्यमान लगभग 1.67 x 10. है-24 जी यह मान 1 μ परमाणु द्रव्यमान इकाई का प्रतिनिधित्व करता है।
न्यूट्रॉन परमाणु नाभिक को स्थिरता प्रदान करता है, क्योंकि परमाणु बल इसे इलेक्ट्रॉनों और प्रोटॉन के प्रति आकर्षित करता है।
केवल हाइड्रोजन परमाणु में न्यूट्रॉन नहीं होता है, जो केवल एक प्रोटॉन के चारों ओर घूमने वाले इलेक्ट्रॉन से बना होता है।
. के लिए नीचे दी गई तालिका की जाँच करें सार उप-परमाणु कणों के बारे में जानकारी के साथ।
| कण | प्रतीक |
पास्ता (. की इकाई में परमाणु भार) |
चार्ज (. की इकाई में इलेक्ट्रिक चार्ज - यू.सी.ई.) |
स्थान |
|---|---|---|---|---|
| प्रोटोन | +1 | कोर | ||
| न्यूट्रॉन | 0 | कोर | ||
| इलेक्ट्रॉन | -1 | इलेक्ट्रोस्फीयर |
अपनी जमीनी अवस्था में एक परमाणु विद्युत रूप से तटस्थ होता है, क्योंकि प्रोटॉन की संख्या इलेक्ट्रॉनों की संख्या के बराबर होती है और विपरीत आवेश, धनात्मक और ऋणात्मक, एक दूसरे को रद्द करते हैं।
उदाहरण के लिए, सोडियम (Na) का परमाणु क्रमांक 11 है, अर्थात इसके नाभिक में 11 प्रोटॉन हैं। नतीजतन, उस तत्व के परमाणु के इलेक्ट्रोस्फीयर में 11 इलेक्ट्रॉन होते हैं।
पर और अधिक पढ़ें परमाण्विक संरचना.
परमाणु संरचना
जैसा कि हम देख चुके हैं, परमाणु का निर्माण एक छोटे और घने मध्य क्षेत्र से होता है जिसे नाभिक कहते हैं और इसके चारों ओर a. होता है इलेक्ट्रोस्फीयर, जहां इलेक्ट्रॉन स्थित होते हैं, जिन्हें इलेक्ट्रॉनिक परतों, ऊर्जा उपस्तरों में विभाजित किया जा सकता है और परमाणु कक्षक।
इलेक्ट्रॉनिक परतें
परमाणु प्रस्तुत करता है उर्जा स्तर, जो एक नाभिक के चारों ओर सात परतों के अनुरूप होते हैं और उनमें इलेक्ट्रॉन होते हैं जो इसके चारों ओर परिक्रमा करते हैं। परतों को K, L, M, N, O, P और Q कहा जाता है।

जैसा कि नीचे दी गई तालिका में दिखाया गया है, प्रत्येक शेल में एक निश्चित संख्या में इलेक्ट्रॉन हो सकते हैं।
| ऊर्जा स्तर | इलेक्ट्रॉनिक परत | इलेक्ट्रॉनों की अधिकतम संख्या |
|---|---|---|
| 1º | क | 2 |
| 2º | ली | 8 |
| 3º | म | 18 |
| 4º | नहीं | 32 |
| 5º | हे | 32 |
| 6º | पी | 18 |
| 7º | क्यू | 8 |
उदाहरण के लिए, हीलियम (He) के परमाणु का परमाणु क्रमांक 2 है और इसलिए नाभिक में 2 प्रोटॉन हैं। नतीजतन, परमाणु के इलेक्ट्रोस्फीयर में केवल 2 इलेक्ट्रॉन होते हैं, जो परमाणु के पहले और एकमात्र इलेक्ट्रॉनिक शेल में स्थित होते हैं, K शेल जो पहले ऊर्जा स्तर से मेल खाता है।
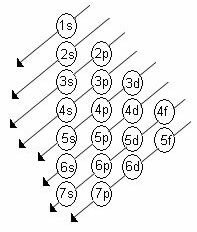
ऊर्जा उपस्तर
एनर्जी लेवल हाउस सबलेवल्स, जिन्हें s, p, d, f द्वारा दर्शाया जाता है। प्रत्येक सबलेवल में अधिकतम इलेक्ट्रॉनों की संख्या होती है, जो क्रमशः 2, 6, 10 और 14 हैं।

इस जानकारी के साथ, यह संभव है इलेक्ट्रॉनिक वितरण एक परमाणु का और सबसे बाहरी और सबसे ऊर्जावान इलेक्ट्रॉन के स्थान को जानें।
उदाहरण: नाइट्रोजन (एन)
परमाणु संख्या: 7
इलेक्ट्रॉनिक वितरण: 1s2 2s2 २पी3
नाइट्रोजन परमाणु में दो ऊर्जा स्तर होते हैं, K और L, और इसके 7 इलेक्ट्रॉन s और p सबलेवल पर कब्जा कर लेते हैं।
कश्मीर: से2 = 2 इलेक्ट्रॉन
एल: s2 + पी3 = 5 इलेक्ट्रॉन
ध्यान दें कि L शेल में अधिकतम 8 इलेक्ट्रॉन हो सकते हैं, लेकिन नाइट्रोजन परमाणु में उस शेल में केवल 5 इलेक्ट्रॉन होते हैं।
परमाणु कक्षक
ऑर्बिटल्स एक इलेक्ट्रॉनिक शेल (K, L, M, N, O, P, Q) में एक ऊर्जावान सबलेवल (s, p, d, f) के भीतर एक इलेक्ट्रॉन खोजने की सबसे अधिक संभावना वाले क्षेत्र की विशेषता रखते हैं।
- एस सबलेवल: इसमें 1 कक्षीय है जो 2 इलेक्ट्रॉनों तक रखता है
- p सबलेवल: इसमें 3 ऑर्बिटल्स होते हैं जिनमें 6 इलेक्ट्रॉन तक होते हैं
- सबलेवल डी: इसमें 5 ऑर्बिटल्स होते हैं जिनमें 10 इलेक्ट्रॉन तक होते हैं
- सबलेवल f: में 7 ऑर्बिटल्स होते हैं जिनमें 14 इलेक्ट्रान तक होते हैं

एक उदाहरण के रूप में फिर से नाइट्रोजन का उपयोग करना और इसके 7 इलेक्ट्रॉनों को परमाणु कक्षा में वितरित करना हमारे पास होगा:

परमाणु प्रकार
प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉनों की संख्या को देखते हुए हम परमाणुओं की तुलना कर सकते हैं और उन्हें वर्गीकृत कर सकते हैं आइसोटोप, आइसोबार्स तथा आइसोटोन्स.
एक रासायनिक तत्व को समान संख्या में प्रोटॉन वाले परमाणुओं के समूह के रूप में परिभाषित किया जा सकता है। इन परमाणुओं को समस्थानिक कहा जाता है क्योंकि इनका परमाणु क्रमांक और द्रव्यमान भिन्न होता है।
उदाहरण के लिए, प्रकृति में तत्व हाइड्रोजन (H) के 3 समस्थानिक हैं: प्रोटियम ड्यूटेरियम
और ट्रिटियम
.
विभिन्न रासायनिक तत्वों के परमाणुओं को आइसोटोन के रूप में वर्गीकृत किया जा सकता है, जब उनके परमाणु क्रमांक और द्रव्यमान भिन्न होते हैं, लेकिन न्यूट्रॉन की संख्या समान होती है।
आइसोबार विभिन्न तत्वों के परमाणु होते हैं, अर्थात उनके परमाणु क्रमांक भिन्न होते हैं, लेकिन द्रव्यमान संख्या समान होती है।
पर और अधिक पढ़ें आइसोटोप, आइसोबार और आइसोटोन.
परमाणु मॉडल (परमाणु मॉडल)
यूनानी दार्शनिक अरस्तू (384 ई. सी। - 322 ए. ग) पृथ्वी, वायु, अग्नि और जल तत्वों से सभी पदार्थों के गठन की व्याख्या करने का प्रयास किया।
डेमोक्रिटस (546 ए. सी - 460 ए। सी), एक यूनानी वैज्ञानिक और गणितज्ञ ने इस विचार को प्रतिपादित किया कि कणों के छोटे होने की एक सीमा होती है। उन्होंने कहा कि वे इतने छोटे हो जाएंगे कि वे अब विभाजित नहीं हो सकते। उन्होंने इस कण को "परमाणु" कहा।
19वीं सदी के अधिकांश समय के लिए, यह था डाल्टन परमाणु मॉडल, अंग्रेजी वैज्ञानिक, जिन्होंने परमाणु सिद्धांत का प्रस्ताव रखा, जो पूर्वजों के विचार से बहुत आगे निकल गया।
इस सिद्धांत ने कहा कि सभी पदार्थ छोटे अविभाज्य कणों से बने होते हैं जिन्हें परमाणु कहा जाता है, जो बिलियर्ड गेंदों की तरह होंगे। जैसे-जैसे पदार्थ की संरचना पर अध्ययन आगे बढ़ा, यह पता चला कि परमाणु अन्य छोटे कणों से बनता है जिन्हें उप-परमाणु कण कहा जाता है।
इलेक्ट्रॉन की खोज के साथ, थॉमसन उन्होंने मास पुडिंग के रूप में जाना जाने वाला मॉडल तैयार किया, जिसने परमाणु को एक सकारात्मक क्षेत्र के रूप में वर्णित किया, जिसकी सतह में नकारात्मक रूप से चार्ज किए गए इलेक्ट्रॉन एम्बेडेड हैं।
प्रयोगों के माध्यम से भौतिक विज्ञानी रदरफोर्ड पाया कि परमाणु में एक अत्यंत छोटे, धनात्मक नाभिक के चारों ओर रिक्तियां और इलेक्ट्रॉन थे। इस प्रकार, रदरफोर्ड ने परमाणु का प्रतिनिधित्व करने के लिए परमाणु मॉडल का प्रस्ताव रखा।
बोहरा रदरफोर्ड द्वारा प्रस्तावित मॉडल में सुधार करते हुए यह पाया गया कि इलेक्ट्रॉन नाभिक के चारों ओर यादृच्छिक रूप से नहीं, बल्कि विशिष्ट कक्षाओं में घूमते हैं। इस मॉडल को तारामंडल के रूप में जाना जाने लगा।
इसके बारे में भी पढ़ें:
- परमाणु मॉडल
- थॉमसन परमाणु मॉडल
- बोहर का परमाणु मॉडल
- रदरफोर्ड परमाणु मॉडल
- परमाणु मॉडल का विकास