हेस का नियम हमें एन्थैल्पी भिन्नता की गणना करने की अनुमति देता है, जो रासायनिक प्रतिक्रियाओं से गुजरने के बाद पदार्थों में मौजूद ऊर्जा की मात्रा है। इसका कारण यह है कि थैलेपी को स्वयं मापना संभव नहीं है, बल्कि इसकी भिन्नता है।
हेस का नियम थर्मोकैमिस्ट्री के अध्ययन का आधार है।
यह कानून प्रयोगात्मक रूप से जर्मेन हेनरी हेस द्वारा विकसित किया गया था, जिन्होंने स्थापित किया था:
रासायनिक अभिक्रिया में एन्थैल्पी परिवर्तन (ΔH) अभिक्रियाओं की संख्या की परवाह किए बिना केवल अभिक्रिया की प्रारंभिक और अंतिम अवस्थाओं पर निर्भर करता है।
हेस के नियम की गणना कैसे की जा सकती है?
अंतिम एन्थैल्पी (प्रतिक्रिया के बाद) से प्रारंभिक एन्थैल्पी (प्रतिक्रिया से पहले) को घटाकर एन्थैल्पी परिवर्तन की गणना की जा सकती है:
एच = एचएफ - होमैं
इसकी गणना करने का एक अन्य तरीका मध्यवर्ती प्रतिक्रियाओं में से प्रत्येक में थैलेपी के योग के माध्यम से है। प्रतिक्रियाओं की संख्या और प्रकार की परवाह किए बिना।
एच = एच1 + H2
चूंकि यह गणना केवल प्रारंभिक और अंतिम मूल्यों पर विचार करती है, इसलिए यह निष्कर्ष निकाला जाता है कि मध्यवर्ती ऊर्जा इसकी भिन्नता के परिणाम को प्रभावित नहीं करती है।
यह एक विशेष मामला है ऊर्जा संरक्षण का सिद्धांत, ए ऊष्मप्रवैगिकी का पहला नियम.
आपको यह भी पता होना चाहिए कि हेस के नियम की गणना गणितीय समीकरण के रूप में की जा सकती है। इसके लिए आप निम्नलिखित क्रियाएं कर सकते हैं:
- रासायनिक प्रतिक्रिया को उलट दें, जिस स्थिति में ΔH चिन्ह को भी उलट दिया जाना चाहिए;
- समीकरण को गुणा करें, ΔH का मान भी गुणा किया जाना चाहिए;
- समीकरण को विभाजित करें, H के मान को भी विभाजित किया जाना चाहिए।
के बारे में अधिक जानें तापीय धारिता.
एन्थैल्पी आरेख
हेस के नियम को ऊर्जा आरेखों के माध्यम से भी देखा जा सकता है:
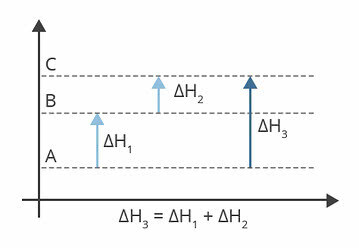
ऊपर दिया गया चित्र एन्थैल्पी स्तरों को दर्शाता है। इस मामले में, जो प्रतिक्रियाएं होती हैं, वे एंडोथर्मिक होती हैं, यानी ऊर्जा अवशोषण होता है।
एच1 ए से बी में होने वाला एन्थैल्पी परिवर्तन है। मान लीजिए कि यह 122 kj है।
एच2 B से C में होने वाला एन्थैल्पी परिवर्तन है। मान लीजिए कि यह 224 kj है।
एच3 ए से सी में होने वाला एन्थैल्पी परिवर्तन है।
अतः हमारे लिए H. का मान जानना महत्वपूर्ण है3, क्योंकि यह A से C तक अभिक्रिया की एन्थैल्पी में परिवर्तन के अनुरूप है।
हम H. का मान ज्ञात कर सकते हैं3, प्रत्येक अभिक्रिया में एन्थैल्पी के योग से:
एच3 = H1 + H2
एच3 = 122 केजे + 224 केजे
एच3 = ३४६ kj
या एच = एचएफ - होमैं
H = 346 kj - 122 kj
H = 224 kj
प्रवेश परीक्षा: चरण दर चरण हल
1. (फुवेस्ट-एसपी) निम्नलिखित प्रतिक्रियाओं से जुड़े थैलेपी भिन्नताओं के आधार पर:
नहीं2(जी) + 2 ओ2(जी) → 2 नहीं2(जी) H1 = +67.6 kJ
नहीं2(जी) + 2 ओ2(जी) → एन2हे4(जी) H2 = +9.6 kJ
यह अनुमान लगाया जा सकता है कि NO डिमराइजेशन रिएक्शन से जुड़ी थैलेपी भिन्नता2 के बराबर होगा:
2 नहींओ 2 (जी) → 1 एन2हे4(जी)
ए) -58.0 केजे बी) +58.0 केजे सी) -77.2 केजे डी) +77.2 केजे ई) +648 केजे
संकल्प:
चरण 1: पहले समीकरण को उल्टा करें। ऐसा इसलिए है क्योंकि नहीं2(जी) इसे वैश्विक समीकरण के अनुसार अभिकारकों की ओर ले जाने की आवश्यकता है। याद रखें कि प्रतिक्रिया को उलटते समय, ∆H1 भी संकेत को उलट देता है, इसे नकारात्मक में बदल देता है।
दूसरा समीकरण संरक्षित है।
2 नहीं2(जी) → एन2(जी) + 2 ओ2(जी) H1 = - ६७.६ केजे
नहीं2(जी) + 2 ओ2(जी) → एन2हे4(जी) H2 = +9.6 kJ
चरण 2: ध्यान दें कि N2(जी) उत्पादों और अभिकर्मकों में दिखाई देता है और O. के 2 mol के साथ भी ऐसा ही होता है2 (जी)।
2 नहीं2(जी) → नहीं2(जी)+ 2 ओ2(जी)H1 = - ६७.६ केजे
नहीं2(जी) + 2 ओ2(जी) → एन2हे4(जी) H2 = +9.6 kJ
इस प्रकार, उन्हें निम्नलिखित समीकरण के परिणामस्वरूप रद्द किया जा सकता है:
2 नहीं2(जी) → एन2हे4(जी).
चरण 3: आप देख सकते हैं कि हम वैश्विक समीकरण पर पहुंच गए हैं। अब हमें समीकरणों को जोड़ना होगा।
H = ∆H1 + H2
H = - ६७.६ kJ + ९.६ kJ
∆H = -58 kJ वैकल्पिक A
H के ऋणात्मक मान से हम यह भी जानते हैं कि यह ऊष्मा के निकलने के साथ एक ऊष्माक्षेपी अभिक्रिया है।
और जानें, ये भी पढ़ें:
- ऊष्मारसायन
- थर्मोकैमिस्ट्री पर अभ्यास
- एंडोथर्मिक और एक्ज़ोथिर्मिक प्रतिक्रियाएं
- ऊष्मप्रवैगिकी का दूसरा नियम
अभ्यास
1. (यूडीईएससी-2012) मीथेन गैस का उपयोग ईंधन के रूप में किया जा सकता है, जैसा कि समीकरण 1 में दिखाया गया है:
चौधरी4(जी) + 2O2(जी) → सीओ2(जी) + 2H2हे(छ)
नीचे दिए गए थर्मोकेमिकल समीकरणों का उपयोग करना, जिन्हें आप आवश्यक समझते हैं, और हेस के नियम की अवधारणाएं, समीकरण 1 का थैलेपी मान प्राप्त करते हैं।
सी(ओं) + एच2हे(छ) → सीओ(छ) + एच2(जी) ΔH = १३१.३ kJ mol-1
सीओ(छ) + ½ थी2(जी) → सीओ2(जी) H = - २८३.० kJ mol-1
एच2(जी) + ½ थी2(जी) → एच2हे(छ) ΔH = - 241.8 kJ mol-1
सी(ओं) + 2H2(जी) → सीएच4(जी) H = - ७४.८ kJ mol-1
kJ में समीकरण 1 का एन्थैल्पी मान है:
क) - 704.6
बी) - 725.4
ग) - 802.3
घ) - 524.8
ई) - 110.5
ग) - 802.3
2. (UNEMAT-2009) थर्मोकैमिस्ट्री के अध्ययन में हेस का नियम मौलिक महत्व का है और कहा जा सकता है के रूप में "रासायनिक प्रतिक्रिया में थैलेपी की भिन्नता केवल प्रारंभिक और अंतिम अवस्थाओं पर निर्भर करती है" प्रतिक्रिया"। हेस के नियम के परिणामों में से एक यह है कि थर्मोकेमिकल समीकरणों को बीजगणितीय रूप से माना जा सकता है।
समीकरणों को देखते हुए:
सी (ग्रेफाइट) + ओ2(जी) → सीओ2(जी) एच1 = -393.3 kj
सी (हीरा) + ओ2(जी) → सीओ2(जी) एच2 = -395.2 kj
उपरोक्त जानकारी के आधार पर ग्रेफाइट कार्बन के डायमंड कार्बन में एन्थैल्पी परिवर्तन की गणना करें और सही विकल्प पर निशान लगाएं।
क) -788.5 kj
बी) +1.9 केजे
ग) +788.5 kj
घ) -1.9 kj
ई) +98.1 kj
बी) +1.9 केजे

