ऊष्मप्रवैगिकी का तीसरा नियम पदार्थ के व्यवहार से संबंधित है जिसमें एक एन्ट्रापी शून्य के करीब है।
इस नियम के अनुसार, जब भी कोई निकाय ऊष्मागतिक साम्यावस्था में होता है, तो उसकी एन्ट्रापी शून्य तक पहुँच जाती है।
ऊष्मप्रवैगिकी का दूसरा नियम एन्ट्रापी से संबंधित है। इसके बाद, तीसरा कानून एक के रूप में प्रकट होता है एक पूर्ण संदर्भ बिंदु स्थापित करने का प्रयास जो एन्ट्रापी को निर्धारित करता है.
वाल्थर नर्नस्ट (1864-1941) भौतिक विज्ञानी थे जिन्होंने थर्मोडायनामिक्स के तीसरे नियम के आधार का निर्माण करने वाले सिद्धांतों से निपटा।
नर्नस्ट के अनुसार, यदि किसी शुद्ध पदार्थ का तापमान निरपेक्ष शून्य के बराबर या उसके करीब हो तो एन्ट्रापी का न्यूनतम मान होगा।
उसके लिए, नर्नस्ट ने नीचे दिए गए सूत्र का प्रस्ताव दिया, जो दर्शाता है कि एन्ट्रापी (ΔS) और तापमान (T) की भिन्नता न्यूनतम मानों की ओर ले जाती है, अर्थात 0:
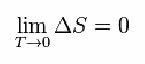
लेकिन एंट्रोपी क्या है?
एन्ट्रापी इस तरह से अणु सिस्टम में खुद को व्यवस्थित करते हैं। यह संगठन अव्यवस्था में तब्दील होता है, भ्रम के अर्थ में नहीं, बल्कि अणुओं की गति और गति के अर्थ में।
जितने अधिक अणु गति कर सकते हैं, वे उतने ही अव्यवस्थित होते हैं, उनके पास उतनी ही अधिक एन्ट्रापी होती है।
प्रारंभ में, नर्नस्ट ने सुझाव दिया कि उनके द्वारा प्रस्तावित एन्ट्रापी केवल पूर्ण क्रिस्टल पर ही संभव होगी।
अंत में, उन्होंने निष्कर्ष निकाला कि पूर्ण शून्य के बराबर तापमान मौजूद नहीं था, जो तीसरे कानून को एक विवादास्पद कानून बनाता है।
तो, कई भौतिकविदों के लिए, यह एक कानून नहीं बल्कि एक नियम है।
इतने वर्षों के बाद (1912 से), वैज्ञानिक इस तापमान या तापमान को प्राप्त करने का प्रयास करते हैं जो पूर्ण शून्य के करीब और करीब आते हैं। इस प्रकार, उन्होंने पाया कि यह केवल गैसों में ही संभव है, किसी भी पदार्थ को ठोस या तरल अवस्था में छोड़ना।
यह भी पढ़ें:
- ऊष्मप्रवैगिकी का शून्य नियम
- ऊष्मप्रवैगिकी का पहला नियम
- ऊष्मप्रवैगिकी का दूसरा नियम
- ऊष्मप्रवैगिकी पर व्यायाम