खुद को परिभाषित करता है संकरण अधूरे परमाणु कक्षकों का मिलन। एक कक्षीय को अपूर्ण के रूप में वर्गीकृत किया जाता है जब उसमें केवल एक इलेक्ट्रॉन इसके अंदर दो के बजाय। अपूर्ण कक्षीय और पूर्ण कक्षीय का प्रतिनिधित्व देखें:

छवि ए में, हमारे पास एक पूर्ण कक्षीय है; छवि बी में, एक अपूर्ण कक्षीय।
संकरण एक प्राकृतिक घटना है जो कुछ रासायनिक तत्वों, जैसे फास्फोरस, सल्फर, कार्बन आदि के साथ होती है। कार्बन का संकरण इस तत्व के परमाणुओं को चार रासायनिक बंधन बनाने में सक्षम बनाता है, अर्थात कार्बन संकरण की घटना से गुजरने के बाद ही चार बंधन बनाता है।
लेकिन कार्बन क्यों संकरण करता है और चार बंधन बनाता है? इस परिघटना को समझने के लिए हमें इस तत्व के इलेक्ट्रॉनिक वितरण को जानना होगा:
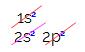
कार्बन के इलेक्ट्रॉनिक वितरण में, हम देखते हैं कि 1s सबलेवल पूर्ण है (दो इलेक्ट्रॉनों के साथ), 2s है पूर्ण (दो इलेक्ट्रॉनों के साथ) और 2p सबलेवल अधूरा है (पी सबलेवल छह इलेक्ट्रॉनों का समर्थन करता है, लेकिन केवल है दो)। 2p इलेक्ट्रॉनों को प्रतिनिधि तरीके से वितरित करते हुए, हमें यह करना होगा:
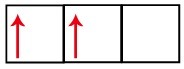
p सबलेवल में तीन ऑर्बिटल्स होते हैं - कार्बन के मामले में, उनमें से दो अधूरे हैं और एक खाली है। इस कारण से, इस तत्व को केवल दो लिंक करना चाहिए, क्योंकि अपूर्ण ऑर्बिटल्स की संख्या हमेशा लिंक की संख्या निर्धारित करती है।
हालाँकि, बाहरी वातावरण से ऊर्जा प्राप्त करते समय, कार्बन में मौजूद इलेक्ट्रॉन उत्तेजित होते हैं। इस प्रकार, सबलेवल 2s में मौजूद इलेक्ट्रॉनों में से एक सबलेवल p के ऑर्बिटल में चला जाता है जो खाली था:
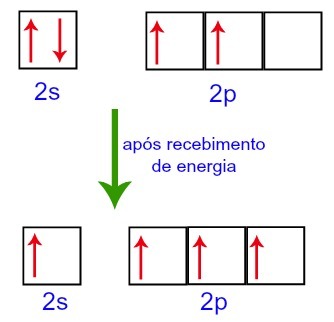
बाहरी वातावरण से ऊर्जा प्राप्त करने से पहले और बाद में कार्बन ऑर्बिटल्स
इस प्रकार, कार्बन अपने दूसरे स्तर पर चार अधूरे कक्षकों के साथ रह जाता है। फिर, 2s सबलेवल ऑर्बिटल तीन p ऑर्बिटल्स में शामिल हो जाता है, जो संकरण।
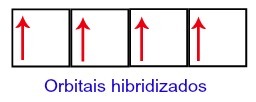
संकरण के बाद कार्बन ऑर्बिटल्स
मेरे द्वारा। डिओगो लोपेज डायस
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm
