आयनीकरण ऊर्जा है a आवधिक संपत्ति जो एक परमाणु से जमीनी अवस्था में इलेक्ट्रॉन को स्थानांतरित करने के लिए आवश्यक ऊर्जा को इंगित करती है.
एक परमाणु अपनी जमीनी अवस्था में होता है जब उसके प्रोटॉन की संख्या उसके इलेक्ट्रॉनों की संख्या के बराबर होती है।
परमाणु से इलेक्ट्रॉन का स्थानांतरण आयनीकरण कहलाता है। इसलिए, इसके होने के लिए आवश्यक ऊर्जा को आयनीकरण ऊर्जा कहा जाता है, जिसे. के रूप में भी जाना जाता है आयनीकरण क्षमता.
हटाया गया पहला इलेक्ट्रॉन वह है जो परमाणु के नाभिक से सबसे दूर होता है। दूरी स्थानांतरण की सुविधा प्रदान करती है क्योंकि नाभिक से जितना दूर होता है, जो सकारात्मक है, इलेक्ट्रॉन को इससे बाहर निकालने के लिए उतनी ही कम ऊर्जा लगती है।
अगले इलेक्ट्रॉन (इलेक्ट्रॉनों) को अधिक ऊर्जा की आवश्यकता होती है। इस प्रकार, हम कह सकते हैं कि पहली आयनीकरण ऊर्जा (ई.आई.) दूसरी आयनीकरण ऊर्जा से कम है। दूसरा, बदले में, तीसरी आयनीकरण ऊर्जा से छोटा है और इसी तरह:
पहला ई.आई
ऐसा इसलिए है क्योंकि परमाणु किरण यह आकार में बढ़ता है क्योंकि प्रत्येक इलेक्ट्रॉन परमाणु से हटा दिया जाता है। नतीजतन, इलेक्ट्रॉन परमाणु नाभिक के करीब और करीब आ रहे हैं।
क्रमिक ऑक्सीजन आयनीकरण ऊर्जा की जाँच करें:
ओ -> ओ+: १३१३.९ kJ mol-1
हे+1 -> ओ+2: ३३८८.२ केजे मोल-१
हे+2 -> ओ+3: ५३००.३ kJ mol-1
हे+3 -> ओ+4: ७४६९.१ kJ mol-1
हे+4 -> ओ+5: 10989.3 kJ mol-1
जब, एक इलेक्ट्रॉन को हटाने के बाद, परमाणु में इलेक्ट्रॉनों की तुलना में अधिक प्रोटॉन होते हैं, तो वह परमाणु एक धनायन बन जाता है।
यह भी पढ़ें:
- आयन, धनायन और ऋणायन
- आयनीकरण
ऐसा होता है, उदाहरण के लिए, जब हम हाइड्रोजन से एक इलेक्ट्रॉन निकालते हैं। हाइड्रोजन 1 प्रोटॉन और 1 इलेक्ट्रॉन से बना है।
इलेक्ट्रॉन को हटाने के बाद, हाइड्रोजन के नाभिक में केवल एक प्रोटॉन होता है। इसका मतलब है कि हाइड्रोजन को आयनित किया गया था और यह एक धनायन बन गया, जो कि यह कहने के समान है कि यह एक सकारात्मक आयन बन गया।
आवर्त सारणी में आयनीकरण ऊर्जा
आवर्त सारणी पर दाएं से बाएं और ऊपर से नीचे की दिशाओं में परमाणु त्रिज्या बढ़ जाती है।
यह जानने से विपरीत दिशा में आयनन ऊर्जा बढ़ती है, अर्थात यह बाएँ से दाएँ और नीचे से ऊपर की ओर अधिक होती है।
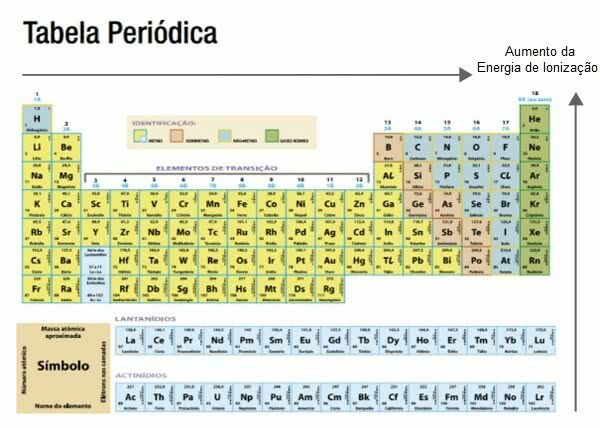
जिन तत्वों को कम आयनीकरण ऊर्जा की आवश्यकता होती है, वे हैं क्षारीय धातु, उदाहरण के लिए, पोटेशियम।
महान गैसें, सामान्य तौर पर, वे हैं जिन्हें उच्च आयनीकरण ऊर्जा की आवश्यकता होती है, उदाहरण के लिए, आर्गन।
निष्कासन ऊर्जा x आयनीकरण ऊर्जा
निष्कासन ऊर्जा आयनीकरण ऊर्जा के समान है। दोनों में अंतर यह है कि निष्कासन ऊर्जा को किसके साथ जोड़ा जा सकता है फोटोइलेक्ट्रिक प्रभाव.
फोटोइलेक्ट्रिक प्रभाव आमतौर पर प्रकाश के संपर्क में आने वाली धातु सामग्री द्वारा उत्सर्जित इलेक्ट्रॉन होते हैं।
नतीजतन, निष्कासन ऊर्जा में इलेक्ट्रॉनों का निष्कासन एक क्रम का पालन नहीं करता है जैसा कि आयनीकरण ऊर्जा के साथ होता है।
आयनीकरण ऊर्जा में, हटाए गए पहले इलेक्ट्रॉन नाभिक से सबसे दूर होते हैं।
इलेक्ट्रॉनिक आत्मीयता
इलेक्ट्रॉनिक आत्मीयता यह परमाणुओं के व्यवहार को भी प्रभावित करता है, लेकिन उल्टा।
यह आवधिक गुण है जो एक परमाणु को एक इलेक्ट्रॉन प्राप्त करने पर जारी ऊर्जा को इंगित करता है। दूसरी ओर, आयनीकरण ऊर्जा एक परमाणु से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा है।
यह भी पढ़ें विद्युत धनात्मकता तथा वैद्युतीयऋणात्मकता.
अभ्यास
1. (पीयूसीआरएस) आवर्त सारणी में तत्वों की स्थिति को ध्यान में रखते हुए, यह कहना सही है कि, नीचे दिए गए तत्वों में से, सबसे छोटी त्रिज्या और उच्चतम आयनीकरण ऊर्जा वाला है
ए) एल्यूमीनियम
बी) आर्गन
सी) फास्फोरस
डी) सोडियम
ई) रूबिडियम
बी) आर्गन
2. (यूईएल) आवधिक वर्गीकरण में, रासायनिक तत्वों की आयनीकरण ऊर्जा बढ़ जाती है
क) अंत से केंद्र तक, आवर्त में।
b) सिरों से केंद्र तक, परिवारों में।
ग) दाएं से बाएं, अवधियों में।
d) परिवारों में ऊपर से नीचे तक।
ई) परिवारों में नीचे से ऊपर तक।
ई) परिवारों में नीचे से ऊपर तक।
3. (यूईसीई) निम्नलिखित तटस्थ परमाणुओं को काल्पनिक प्रतीकों एक्स, वाई, जेड और टी और उनके संबंधित इलेक्ट्रॉनिक कॉन्फ़िगरेशन द्वारा दर्शाया गया है:
एक्स → 1s2
वाई → 1s2 2s2
जेड → 1s2 2s2 २पी6 ३एस2 ३पी6
टी → 1s2 2s2 २पी6 ३एस2 ३पी6 ४एस2
उच्चतम आयनीकरण ऊर्जा वाला है:
ए) वाई
बी) जेड
ग) टी
घ) एक्स
घ) एक्स
4. (Ufes) ब्रोमीन (Z=35) की पहली आयनीकरण ऊर्जा 1,139.9kJ/mol है। उस विकल्प को चिह्नित करें जिसमें केजे/मोल में क्रमशः फ्लोरीन (जेड = 9) और क्लोरीन (जेड = 17) की पहली आयनीकरण ऊर्जा शामिल है।
क) ९३०.० और १,००८.४
बी) 1,008.4 और 930.0
ग) 1,251.1 और 1,681.0
घ) 1,681.0 और 1,251.1
ई) 1,251.0 और 930.0
घ) 1,681.0 और 1,251.1
एक टिप्पणी संकल्प के साथ प्रवेश परीक्षा के प्रश्नों की जाँच करें: आवर्त सारणी पर व्यायाम.



