क्लोराइड वे आयनिक यौगिक होते हैं जिनमें आयन होता है कु-1.
क्लोरीन 17 या 7A परिवार का है, इसकी परमाणु संख्या 17 के बराबर है और इसके वैलेंस शेल (परमाणु का सबसे बाहरी इलेक्ट्रॉन शेल) में 7 इलेक्ट्रॉन हैं। के अनुसार नियम अष्टक का, स्थिर होने के लिए, इस अंतिम कोश में 8 इलेक्ट्रॉन होने चाहिए और इसलिए एक और इलेक्ट्रॉन प्राप्त करने की आवश्यकता होती है। जब ऐसा होता है, अर्थात, जब यह एक इलेक्ट्रॉन प्राप्त करता है, सामान्य रूप से, एक धातु के साथ एक आयनिक बंधन से, एक बनता है।नियॉन क्लोराइड (कु-1), जिस धातु ने इलेक्ट्रॉन को छोड़ दिया वह धनायन बन जाती है और बनने वाला पदार्थ आयनिक होता है।
क्लोराइड हाइड्रोक्लोरिक एसिड (HCℓ .) के साथ एक आधार की प्रतिक्रिया से प्राप्त लवण होते हैं(यहां)). आधार धनायन प्रदान करता है और हाइड्रोक्लोरिक अम्ल क्लोराइड आयन प्रदान करता है:
जेनेरिक बेस + हाइड्रोक्लोरिक एसिड → क्लोराइड + पानी
सीओह + एचकु → सीकु + एच2हे
क्लोराइड सभी के रूप में वर्गीकृत हैं अकार्बनिक लवण, क्योंकि जलीय माध्यम में वे H. के अलावा अन्य धनायन छोड़ते हैं+ और क्लोराइड आयन छोड़ते हैं, हाइड्रॉक्सिल नहीं (OH .)-).
क्लोराइड का नामकरण हमेशा इस नियम का पालन करता है: क्लोराइड +डी + (क्लोरीन से जुड़े तत्व का नाम)। पर आपके सूत्र बनते हैं सूचकांकों के लिए आयन शुल्क का आदान-प्रदान (संख्या जो तत्व प्रतीक के नीचे दाईं ओर है, उस तत्व के परमाणुओं की संख्या को दर्शाती है जो वर्तमान में बंधन बना रहे हैं)।
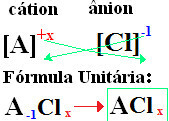
अगर सूचकांक "1" है, आपको इसे सूत्र में लिखने की आवश्यकता नहीं है, जैसा कि नीचे दिखाया गया है:
पर+1 कु-1 → पर1कु1 → परसीℓ: सोडियम क्लोराइड;
क+1 कु-1 → केसीℓ: पोटेशियम क्लोराइड;
यहाँ+2 कु-1→सीएसीℓ2: कैल्शियम क्लोराइड;
बी 0 ए+2 कु-1→बीयहां2बेरियम क्लोराइड;
अज़ी+3 कु-1→एसीℓ3: एल्युमिनियम क्लोराइड।
हालाँकि, जैसा कि पाठ में बताया गया है "समूह के आयनिक पदार्थ: क्लोराइड, कार्बोनेट, नाइट्रेट और सल्फेट”, जैसा कि सभी आयनिक पदार्थों के साथ होता है, क्लोराइड के प्रकृति में पृथक उनके एकात्मक सूत्र नहीं होते हैं, क्योंकि उनके आयन परस्पर एक दूसरे को आकर्षित करते हैं और क्रिस्टल जाली बनाते हैं।
हमारे दैनिक जीवन में क्लोराइड का मुख्य उदाहरण है सोडियम क्लोराइड, NaCℓ, टेबल नमक। आयनिक बंधन देखें जिसके परिणामस्वरूप इसका गठन होता है (जिसमें सोडियम क्लोरीन को एक इलेक्ट्रॉन दान करता है) और इस नमक के क्रिस्टल जाली के नीचे:
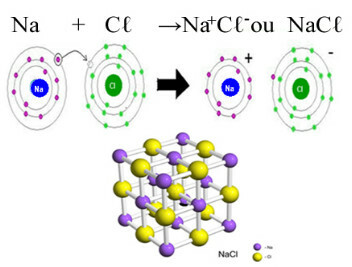
सोडियम क्लोराइड के क्रिस्टलीय जालक में प्रत्येक ऋणायन कु- 6 उद्धरणों से घिरा हुआ है Na+ और इसके विपरीत, इसलिए इस क्रिस्टल जाली की समन्वय संख्या 6 है।
सभी क्लोराइड हैं ठोस परिवेश की स्थितियों में और काफी पानिमे घुलनशील, हमारे दैनिक जीवन में पाए जाने वाले सबसे आम लवणों में से एक होने के नाते, उनमें से कई को देखते हुए मिनरल वाटर, पीने के पानी, नल के पानी, नदियों, समुद्रों में घुले मौजूद हैं अन्य। अपवादों में, पानी में अघुलनशील क्लोराइड होने के कारण, सिल्वर क्लोराइड (AgCℓ - नीचे दिए गए चित्र में दिखाया गया है) हैं। सीसा, तांबा और पारा यौगिक।

पानी में अघुलनशील सिल्वर क्लोराइड*
Cℓ आयन-1 हम जिन क्लोराइडों का सेवन करते हैं, उनमें मुख्य रूप से नमक, मछली और मांसमानव शरीर के कुछ कार्यों के लिए महत्वपूर्ण हैं, क्योंकि वे मुख्य बाह्य आयन हैं, रस में मौजूद हैं present गैस्ट्रिक, शरीर के तरल पदार्थ को विनियमित करते हैं, जैसे शरीर में पानी का वितरण, और प्लाज्मा आसमाटिक दबाव और तटस्थता बनाए रखना बिजली।
इसकी कमी से चिंता, दस्त और संचार संबंधी समस्याएं हो सकती हैं। इसकी अधिकता मूत्र के माध्यम से उत्सर्जित होती है (औसतन, प्रत्येक व्यक्ति प्रति दिन लगभग 4 ग्राम क्लोराइड उत्सर्जित करता है), पसीना और मल।
*छवि क्रेडिट: लेखक: डैनी एस. / से निकाली गई छवि: विकिमीडिया कॉमन्स
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक



