सहसंयोजक बंधन परमाणुओं के बीच एक प्रकार की बातचीत है जिसमें उच्च वैद्युतीयऋणात्मकताअर्थात् इलेक्ट्रॉन ग्रहण करने की उच्च प्रवृत्ति। इस प्रकार के बंधन में आमतौर पर शामिल रासायनिक तत्व हैं:
हाइड्रोजन (एच)
बेरिलियम (बी)
बोरॉन (बी)
कार्बन (सी)
नाइट्रोजन (एन)
फास्फोरस (पी)
ऑक्सीजन (ओ)
सल्फर (एस)
फ्लोरीन (एफ)
क्लोरीन (सीएल)
ब्रोमीन (Br)
आयोडीन (मैं)
ए) शामिल तत्वों की प्रकृति
रासायनिक तत्व जिनमें उच्च विद्युतीयता होती है और फलस्वरूप, सहसंयोजक बंधों को पूरा करते हैं:
हाइड्रोजन
अधातु
बी) सहसंयोजक बंधन की घटना
सहसंयोजक बंधन में शामिल रासायनिक तत्वों की प्रकृति के आधार पर, यह निम्नानुसार हो सकता है:
दो हाइड्रोजन परमाणुओं के बीच;
एक अधातु परमाणु और हाइड्रोजन के बीच;
एक ही रासायनिक तत्व (अधातु) के परमाणुओं के बीच;
विभिन्न रासायनिक तत्वों (दोनों अधातु) के परमाणुओं के बीच।
c) प्रत्येक परमाणु को प्राप्त होने वाले इलेक्ट्रॉनों की संख्या
एक बंधन में प्रत्येक अधातु या हाइड्रोजन परमाणु को प्राप्त होने वाले इलेक्ट्रॉनों की संख्या किससे संबंधित होती है? ओकटेट नियम.
अष्टक नियम के अनुसार, एक परमाणु तब स्थिर होता है जब वह संयोजकता कोश में आठ या दो इलेक्ट्रॉन (केवल हाइड्रोजन के मामले में) प्राप्त करता है। उदाहरण के लिए, यदि किसी परमाणु की संयोजकता कोश में पाँच इलेक्ट्रॉन हैं, तो उसे स्थिरता प्राप्त करने के लिए तीन इलेक्ट्रॉन प्राप्त करने होंगे।
नोट: बेरिलियम और बोरॉन हैं अष्टक नियम के अपवाद, जैसे वे स्थिर हो जाते हैं, क्रमशः, वैलेंस शेल में 4 और 6 इलेक्ट्रॉनों के साथ।
रासायनिक तत्व परिवार का विश्लेषण करके संयोजकता कोश में इलेक्ट्रॉनों की संख्या आसानी से निर्धारित की जा सकती है। नीचे दी गई तालिका में, हमारे पास वैलेंस शेल में इलेक्ट्रॉनों की संख्या है जो उस परिवार से संबंधित है जिससे तत्व संबंधित है और स्थिरता प्राप्त करने के लिए इसे प्राप्त करने वाले इलेक्ट्रॉनों की संख्या:

डी) सहसंयोजक बंधन सिद्धांत
सहसंयोजक बंधन के रूप में, सभी शामिल परमाणुओं में अनिवार्य रूप से इलेक्ट्रॉनों को प्राप्त करने की प्रवृत्ति होती है, उनके बीच वैलेंस शेल (नाभिक से सबसे दूर का स्तर) में मौजूद इलेक्ट्रॉनों का बंटवारा होगा।
साझाकरण तब होता है जब एक परमाणु के वैलेंस शेल से एक इलेक्ट्रॉन उसी इलेक्ट्रॉनिक क्लाउड का हिस्सा बन जाता है जो दूसरे परमाणु के वैलेंस शेल से दूसरे इलेक्ट्रॉन को घेर लेता है।
उदाहरण के लिए, प्रत्येक हाइड्रोजन परमाणु के संयोजकता कोश में एक इलेक्ट्रॉन होता है। जब दो इलेक्ट्रॉन एक ही बादल का हिस्सा बन जाते हैं, तो प्रत्येक हाइड्रोजन में दो वैलेंस इलेक्ट्रॉन होने लगते हैं, यानी यह स्थिर हो जाता है।
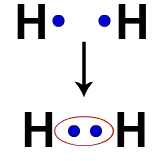
दो हाइड्रोजन परमाणुओं के इलेक्ट्रॉन एक ही इलेक्ट्रॉन बादल पर कब्जा कर लेते हैं
ई) सहसंयोजक बंधन में प्रयुक्त सूत्र
1ª) आण्विक सूत्र
यह सहसंयोजक बंधों से उत्पन्न अणु बनाने वाले प्रत्येक तत्व के परमाणुओं की संख्या का संकेत है।
उदाहरण: हो2हे
पानी के अणु में हमारे पास 2 हाइड्रोजन परमाणु और 1 ऑक्सीजन परमाणु होते हैं।
2ª) संरचनात्मक सूत्र
संरचनात्मक सूत्र अणु के संगठन का प्रदर्शन है, अर्थात यह परमाणुओं के बीच के बंधनों को प्रदर्शित करता है। इसके लिए, प्रत्येक परमाणु के बंधन का प्रतिनिधित्व करने वाले डैश का उपयोग किया जाता है:
सरल (?): इंगित करता है कि परमाणु अपने वैलेंस शेल से केवल एक इलेक्ट्रॉन को दूसरे परमाणु के साथ साझा करता है और इसके विपरीत;
डबल (?): इंगित करता है कि परमाणु ने अपने वैलेंस शेल से दो इलेक्ट्रॉनों को दूसरे परमाणु के साथ साझा किया और इसके विपरीत;
ट्रिपल (≡): इंगित करता है कि परमाणु ने अपने वैलेंस शेल से तीन इलेक्ट्रॉनों को दूसरे परमाणु के साथ साझा किया है और इसके विपरीत।
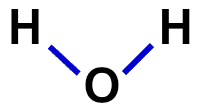
पानी का संरचनात्मक सूत्र
3ª) लुईस का इलेक्ट्रॉनिक सूत्र
लुईस इलेक्ट्रॉनिक सूत्र अणु (इलेक्ट्रॉनिक सूत्र) के संगठन का भी प्रतिनिधित्व करता है, लेकिन इसका उद्देश्य परमाणुओं में इलेक्ट्रॉनों के बंटवारे को प्रदर्शित करना है।
इसे बनाने के लिए, यह एक संरचनात्मक सूत्र में प्रस्तावित संगठन का सम्मान करने के लिए पर्याप्त है और बांड के प्रत्येक निशान (एकल, डबल या ट्रिपल) को "दो गेंदों" से प्रतिस्थापित करता है, जो इलेक्ट्रॉनों का प्रतिनिधित्व करते हैं।
पानी के संरचनात्मक सूत्र में, उदाहरण के लिए, हमारे पास हाइड्रोजन और ऑक्सीजन के बीच दो सरल बंधन हैं। इस प्रकार, उनके बीच, हमारे पास केवल दो गेंदें होंगी, जो एक दीर्घवृत्त (जो इलेक्ट्रॉनिक क्लाउड का प्रतिनिधित्व करती हैं) द्वारा सीमांकित होती हैं।
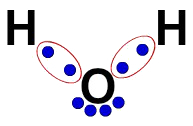
लुईस का पानी का इलेक्ट्रॉनिक सूत्र
मेरे द्वारा। डिओगो लोपेज डायस
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm

