संकरण अधूरे परमाणु ऑर्बिटल्स के संलयन या मिलन को दिया गया नाम है, एक ऐसी घटना जो की संख्या को बढ़ाती है सहसंयोजी आबंध जो एक परमाणु कर सकता है। यह याद रखना कि कक्षीय परमाणु का वह क्षेत्र है जहाँ इलेक्ट्रॉन मिलने की संभावना अधिक होती है।
एक परमाणु द्वारा बनने वाले बंधों की संख्या जानने और. की घटना को समझने के लिए संकरण, परमाणु के बारे में कुछ मूलभूत बिंदुओं को जानना आवश्यक है:
1हे बिंदु: ऊर्जा उपस्तर
एक परमाणु में जो ऊर्जा उपस्तर हो सकते हैं वे हैं s, p, d, f।
2हे बिंदु: उपस्तर प्रति कक्षकों की संख्या
जैसा कि हम नीचे देख सकते हैं, प्रत्येक ऊर्जा सबलेवल में एक अलग मात्रा में ऑर्बिटल्स होते हैं:
सबलेवल एस: 1 कक्षीय;
पी सबलेवल: 3 ऑर्बिटल्स;
सबलेवल डी: 5 ऑर्बिटल्स।
इन कक्षकों का सामान्य निरूपण निम्नानुसार किया जाता है:
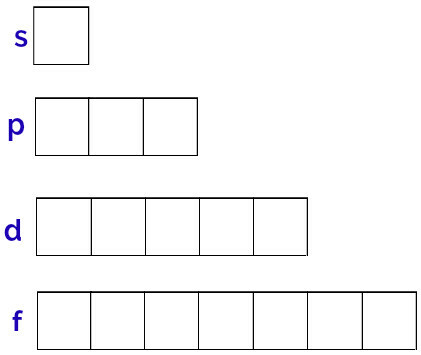
प्रत्येक उपस्तर के कक्षकों का प्रतिनिधित्व
पाउली के अनुसार, एक कक्षक में अधिकतम 2 इलेक्ट्रॉन हो सकते हैं, जिसमें स्पिन (घूर्णन आंदोलनों) विपरीत।
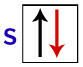
अपने इलेक्ट्रॉनों के साथ s कक्षीय का प्रतिनिधित्व
हंड के अनुसार, एक सबलेवल का एक ऑर्बिटल अपना दूसरा इलेक्ट्रॉन तभी प्राप्त करता है जब उस सबलेवल के अन्य सभी ऑर्बिटल्स को पहले इलेक्ट्रॉन मिल चुके हों।
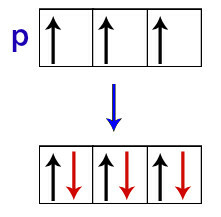
p सबलेवल ऑर्बिटल्स में इलेक्ट्रॉनों का वितरण
3हे बिंदु: इलेक्ट्रॉनिक वितरण
संकरण और एक परमाणु द्वारा बनाए गए बंधों की संख्या को समझने के लिए यह आवश्यक है कि इलेक्ट्रॉनिक वितरण लिनुस पॉलिंग आरेख पर।

लिनुस पॉलिंग आरेख
यह याद रखना कि प्रत्येक उप-स्तर में इलेक्ट्रॉनों की अधिकतम संख्या है:
एस = 2 इलेक्ट्रॉन;
पी = 6 इलेक्ट्रॉन;
डी = 10 इलेक्ट्रॉन;
-
एफ = 14 इलेक्ट्रॉन।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
इस संक्षिप्त समीक्षा के बाद, हम अब परिभाषित कर सकते हैं संकरण क्या है. इसके लिए हम रासायनिक तत्व बोरॉन का प्रयोग करेंगे (परमाणु क्रमांक = 5) एक उदाहरण के रूप में।
जब हम इलेक्ट्रॉनिक बोरॉन वितरण करते हैं, तो हमारे पास होता है:
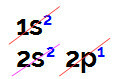
लिनुस पॉलिंग आरेख में इलेक्ट्रॉनिक बोरॉन वितरण
इस वितरण में यह देखा जा सकता है कि बोरॉन में s सबलेवल में 2 इलेक्ट्रान होते हैं और p सबलेवल में 1 इलेक्ट्रान होता है। संयोजकता परत.
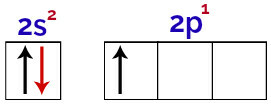
बोरॉन संयोजकता परत के कक्षकों में इलेक्ट्रॉन
चूंकि बोरॉन में 1 अपूर्ण कक्षीय है, इसलिए इसे केवल एक सहसंयोजक बंधन बनाना चाहिए, क्योंकि बांडों की संख्या हमेशा अपूर्ण कक्षाओं की संख्या से सीधे संबंधित होती है।
इस प्रकार, जब बोरॉन परमाणु बाहरी वातावरण से ऊर्जा प्राप्त करता है, तो इसके इलेक्ट्रॉन, विशेष रूप से वैलेंस शेल में, उत्तेजित हो जाते हैं। यह s कक्षीय से इलेक्ट्रॉनों में से एक को खाली p कक्षकों में से एक को छोड़ने और कब्जा करने का कारण बनता है, इस प्रकार 3 अपूर्ण परमाणु कक्षाएँ होती हैं, जैसा कि आप निम्न छवि में देख सकते हैं:

बोरॉन परमाणु की उत्तेजित अवस्था का प्रतिनिधित्व
अंत में, अपूर्ण s कक्षक का अपूर्ण p कक्षकों के साथ मिलन होता है। इस संघ को कहा जाता है संकरण. चूंकि हमारे पास दो पी के साथ एक कक्षीय का संलयन है, इसे कहा जाता है संकरण एसपी2.
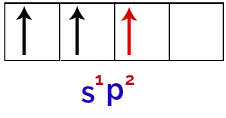
बोरॉन परमाणु में संकरित कक्षकों का प्रतिनिधित्व
बोरॉन के अलावा, कई अन्य रासायनिक तत्व संकरण की घटना से गुजरते हैं, जैसे सल्फर (एस), क्सीनन (एक्सई), भास्वर (पी), कार्बन (सी), फीरोज़ा (बी)।
मेरे द्वारा। डिओगो लोपेज डायस
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
DAYS, डिओगो लोपेज। "संकरण क्या है?"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm. 27 जून, 2021 को एक्सेस किया गया।
बाध्यकारी ऊर्जा, रासायनिक प्रतिक्रियाएं, बंधन तोड़ना, ऊर्जा भिन्नता का अध्ययन, प्रतिक्रियाओं की थैलेपी भिन्नता, ऊर्जा आपूर्ति, अभिकर्मकों के कनेक्शन का टूटना, एंडोथर्मिक प्रक्रिया, ऊर्जा रिलीज, ऊर्जा जारी की गई गठन