गठन थैलीपी, यह भी कहा जाता है गठन की मानक थैलीपीpy, या गठन की मानक गर्मी, मानक अवस्था में, साधारण पदार्थों से पदार्थ के 1 मोल के निर्माण में जारी या अवशोषित ऊष्मा की गणना है।
प्रत्येक पदार्थ की एन्थैल्पी के निरपेक्ष मान की गणना करना असंभव है, लेकिन एक कैलोरीमीटर के माध्यम से प्रतिक्रिया में होने वाली थैलेपी में भिन्नता की गणना करना संभव है।
यह याद रखना आवश्यक है कि मानक अवस्था में साधारण पदार्थों के लिए शून्य के बराबर एन्थैल्पी मान अपनाने पर सहमति हुई. इस प्रकार, यदि हम यह पता लगाना चाहते हैं कि किसी पदार्थ के बनने की एन्थैल्पी क्या है, तो हमें केवल साधारण पदार्थों से इसकी गठन प्रतिक्रिया की एन्थैल्पी का मूल्य जानने की आवश्यकता है।
उदाहरण के लिए, हम १८ ग्राम पानी की एन्थैल्पी ज्ञात करना चाहते हैं, जो १ मोल से मेल खाती है, क्योंकि इसका दाढ़ द्रव्यमान १८ ग्राम/मोल है। ऐसा करने के लिए, हमें पहले सरल पदार्थों से पानी बनाने की प्रतिक्रिया की आवश्यकता है, जैसा कि नीचे दिखाया गया है:
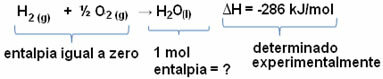
ध्यान दें कि इस प्रतिक्रिया में होने वाले थैलेपी परिवर्तन का मूल्य प्रयोगात्मक रूप से कैलोरीमीटर के माध्यम से निर्धारित किया गया था और यह -286 kJ/mol के बराबर है।
इस एन्थैल्पी परिवर्तन (ΔH) की गणना करने वाला सूत्र है:
एच = एचउत्पादों - होअभिकर्मकों
इस प्रकार, चूँकि हम पहले से ही ΔH का मान जानते हैं और अभिकारकों की एन्थैल्पी शून्य के बराबर है (क्योंकि वे मानक अवस्था में सरल पदार्थ हैं), तब हम निष्कर्ष निकाल सकते हैं कि 1 मोल पानी का थैलेपी मान गठन प्रतिक्रिया के थैलेपी परिवर्तन के बराबर है, क्योंकि यह उस प्रतिक्रिया का एकमात्र उत्पाद है, जैसा कि दिखाया गया है बोले:
एच = एचउत्पादों - होअभिकर्मकों
-286 केजे/मोल = एचH2O - (एचएच 2 + एच1/2 हे2)
-286 केजे/मोल = एचएच2ओ - 0
एचH2O = - 286 kJ/mol
मानक अवस्था में साधारण पदार्थों की एन्थैल्पी से प्राप्त इस प्रकार की एन्थैल्पी इसलिए है गठन की मानक थैलीपी (ΔH .)0).
अब, ऐसे कई पदार्थ हैं जो सीधे एक प्रतिक्रिया से नहीं बनते हैं, जैसे कि पानी। ऐसे मामलों में, गठन की थैलीपी की गणना प्रतिक्रिया के थैलेपी भिन्नता से की जा सकती है।
उदाहरण के लिए, एनएच4Cl निम्नलिखित प्रतिक्रिया से बनता है:
राष्ट्रीय राजमार्ग3 + एचसीएल → एनएच4क्लोरीन ΔH = -176 kJ/mol
ध्यान दें कि कोई भी अभिकारक सरल पदार्थ नहीं है, इसलिए हम उन्हें शून्य की एन्थैल्पी नहीं दे सकते। हमें प्रत्येक अभिकर्मक के गठन की एन्थैल्पी जानने की आवश्यकता है, क्योंकि ये साधारण पदार्थों के बीच प्रतिक्रियाओं से बनते हैं:
राष्ट्रीय राजमार्ग3: H = -46 kJ/mol
एचसीएल: ΔH = -92.4 kJ/mol
इन दोनों एन्थैल्पी को एक साथ जोड़ने पर, हमें अभिकारकों की एन्थैल्पी का मान प्राप्त होता है और हम NH की एन्थैल्पी ज्ञात कर सकते हैं।4सीएल:
एचआर = एचNH3 + एचएचसीएल
एचआर = (-46 + (-९२.४) kJ/mol)
एचआर = -138.4 kJ/mol
सूत्र में प्रतिस्थापन:
एच = एचउत्पादों - होअभिकर्मकों
-176 = एचNH4Cl - ( -138,4)
एचNH4Cl = - 176 - 138,4
एचNH4Cl = -314.4 kJ/mol
इस मामले में, हमने सीधे अभिकारकों के गठन के उत्साह के मूल्यों को अभिव्यक्त किया क्योंकि प्रतिक्रिया अनुपात केवल 1 mol था। तथापि, यदि अन्य अभिक्रियाओं में मोलों की मात्रा भिन्न है, तो पहले अभिकारक के बनने की एन्थैल्पी को मोलों की संख्या से गुणा करना आवश्यक होगा।
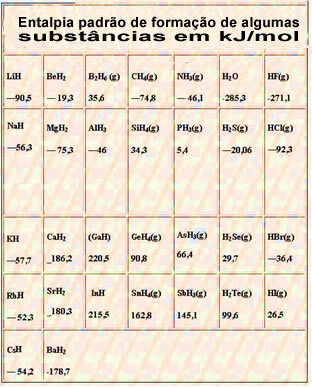
नीचे 25 डिग्री सेल्सियस और 1 एटीएम पर कुछ पदार्थों के गठन की मानक थैलेपी वाली एक तालिका है:
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm