गैस और भाप
महत्वपूर्ण तापमान से गैस और भाप के बीच का अंतर दिया जाता है। वाष्प एक गैसीय अवस्था में पदार्थ है, एक ऐसी अवस्था जिसे बढ़ते दबाव से द्रवीभूत किया जा सकता है। गैस समान नहीं है। यह एक ऐसा द्रव है जिसे दबाव में साधारण वृद्धि से द्रवीभूत नहीं किया जा सकता है। यह गैस को भाप से अलग बनाता है।
गैसों का व्यवहार
गैसीय अवस्था में दिया गया पदार्थ एक गैस है यदि इसका तापमान महत्वपूर्ण तापमान से अधिक है, यदि तापमान महत्वपूर्ण तापमान के बराबर या उससे कम है तो पदार्थ वाष्प है।
वास्तविक गैसें जिन्हें हम सामान्य रूप से जानते हैं, जैसे हीलियम, नाइट्रोजन और ऑक्सीजन, में प्रत्येक की अलग और विशेष आणविक विशेषताएं होती हैं। हालांकि, अगर हम उन सभी को उच्च तापमान और कम दबाव पर रखते हैं, तो वे बहुत समान व्यवहार दिखाना शुरू कर देते हैं। गैसों के अध्ययन में, एक सरल सैद्धांतिक मॉडल अपनाया जाता है, जो वास्तविक गैसों के समान व्यवहार के साथ व्यवहार में मौजूद नहीं होता है। यह सन्निकटन दबाव जितना कम होगा और तापमान उतना ही बेहतर होगा। इस गैस मॉडल को कहा जाता है उत्तम गैस.
१७वीं और १९वीं शताब्दी के आसपास, तीन वैज्ञानिक (जैक्स चार्ल्स, लुई जे. गे-लुसाक और पॉल ई। क्लेपेरॉन), गैसों के व्यवहार का अध्ययन करने के बाद, आदर्श गैसों के व्यवहार को नियंत्रित करने वाले विस्तृत कानूनों को आदर्श गैसें भी कहा जाता है। उनके द्वारा निर्धारित कानून आदर्श गैस के "बाहरी" व्यवहार के नियमों को स्थापित करते हैं, जिसके कारण यह केवल उन भौतिक राशियों को गिनता है जो उनसे जुड़ी हैं, जो हैं: आयतन, तापमान और दबाव।
उत्तम गैसों का सामान्य नियम
वह व्यंजक जो पूर्ण गैसों के सामान्य नियम को निर्धारित करता है, उसे इस प्रकार देखा जा सकता है:
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
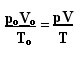
जहां पीहे, वीहे और टीहे क्रमशः प्रारंभिक दबाव, प्रारंभिक मात्रा और प्रारंभिक तापमान हैं। यह एक अभिव्यक्ति है जिसका उपयोग तब किया जाता है जब गैस के चर भिन्न होते हैं।
बाॅय्ल का नियम
रॉबर्ट बॉयल, भौतिक विज्ञानी और रसायनज्ञ, वह थे जिन्होंने उस कानून को निर्धारित किया जो गैस द्वारा किए गए परिवर्तनों को नियंत्रित करता है, जब इसका तापमान स्थिर रखा जाता है। उनका नियम कहता है कि जब कोई गैस एक समतापी परिवर्तन से गुजरती है, तो उसका दबाव व्याप्त आयतन के व्युत्क्रमानुपाती होता है। इस नियम से हमें यह प्राप्त होता है कि कैसे टीहे = टी हमें करना ही होगा:
पीहेवीहे = पीवी
चार्ल्स का नियम
चार्ल्स का नियम वह नियम है जो एक आदर्श गैस के स्थिर आयतन में परिवर्तन को नियंत्रित करता है। इन परिवर्तनों को आइसोकोरिक या आइसोमेट्रिक ट्रांसफ़ॉर्मेशन कहा जाता है। इस नियम के अनुसार, जब एक पूर्ण गैस द्रव्यमान एक समद्विबाहु परिवर्तन से गुजरता है, तो उसका दबाव उसके पूर्ण तापमान के सीधे आनुपातिक होता है। गणितीय रूप से इस नियम को इस प्रकार व्यक्त किया जा सकता है:

जहां पीहे और टीहे क्रमशः प्रारंभिक दबाव और प्रारंभिक तापमान हैं।
गे-लुसाक का नियम
गे-लुसाक का नियम वह नियम है जो निरंतर दबाव में एक आदर्श गैस के परिवर्तन को नियंत्रित करता है। गे-लुसाक नाम रखने के बावजूद इस कानून की खोज भौतिक विज्ञानी और रसायनज्ञ ए.सी. चार्ल्स ने पहले ही कर ली थी। कानून के अनुसार, जब एक गैस एक समदाब रेखीय परिवर्तन से गुजरती है, तो गैस का आयतन उसके निरपेक्ष तापमान के सीधे आनुपातिक होता है। गणितीय रूप से इस नियम को इस प्रकार व्यक्त किया जा सकता है:

जहां वीहे और टीहे क्रमशः प्रारंभिक मात्रा और प्रारंभिक तापमान के अनुरूप।
मार्को ऑरेलियो डा सिल्वा द्वारा
और देखें!!
गैस परिवर्तन
जानिए क्या होते हैं गैस ट्रांसफॉर्मेशन।
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
सैंटोस, मार्को ऑरेलियो डा सिल्वा। "गैसों का अध्ययन"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. 27 जून, 2021 को एक्सेस किया गया।