लिखित मे "शीर्षक या द्रव्यमान प्रतिशतहमने देखा कि ठोस, द्रव और गैसीय विलयनों के लिए विलेय के द्रव्यमान और विलयन के द्रव्यमान के अनुपात की गणना कैसे की जाती है। इस पाठ में, हालांकि, हम देखेंगे कि तरल या गैसीय घटकों के समाधान के लिए, मात्रा के संदर्भ में अनुमापांक की गणना करना भी संभव है।

आयतन में शीर्षक की गणना व्यंजक द्वारा की जा सकती है:
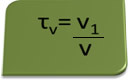
एक उदाहरण के रूप में एक एंटीसेप्टिक और कीटाणुनाशक के रूप में उपयोग किए जाने वाले एथिल अल्कोहल के जलीय घोल पर विचार करें, जो था १०० मिलीलीटर. की मात्रा बनाने के लिए पर्याप्त पानी में ७० मिलीलीटर शुद्ध अल्कोहल मिलाकर तैयार किया जाता है समाधान। तो हमारे पास:
τ = 70 मिली = 0,7
100 मिलीलीटर
हम शीर्षक को प्रतिशत में भी व्यक्त कर सकते हैं, बस परिणाम को १००% से गुणा कर सकते हैं। तो इस मामले में हमारे पास 70% एथिल अल्कोहल समाधान है, जिसका अर्थ है कि समाधान की प्रत्येक 100 मात्रा इकाइयों में से 70 मात्रा इकाइयां अल्कोहल हैं।
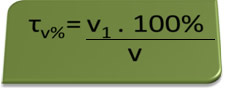
नीचे के मामले में, हमारे पास २५० मिलीलीटर की मात्रा में घोल में ७०% एथिल अल्कोहल समाधान है; जिसका अर्थ है कि गणना के अनुसार 175 एमएल अल्कोहल है:
100 एमएल 70 एमएल अल्कोहल
२५० एमएल x
एक्स = 70. 250
100
एक्स = 175 एमएल अल्कोहल

हालाँकि, हम यह नहीं कह सकते कि इस मामले में हमारे पास 75 mL (250-175) पानी है। द्रव्यमान अनुमापांक के विपरीत, जिसमें हम विलयन का द्रव्यमान ज्ञात करने के लिए विलेय के द्रव्यमान में विलायक के द्रव्यमान को जोड़ सकते हैं, यह आयतन अनुमापांक के संबंध में नहीं किया जा सकता है।

अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
इसका मतलब यह है कि समाधान की मात्रा विलायक की मात्रा और विलेय मात्रा के योग के बराबर नहीं है (हालांकि अक्सर अंतर को नगण्य माना जा सकता है)। ऐसा इसलिए है क्योंकि इन तरल पदार्थों में मौजूद अंतर-आणविक बल अंतिम मात्रा को प्रभावित करते हैं।
उपरोक्त समाधान के मामले में, एथिल अल्कोहल, उदाहरण के लिए, जब हम शराब को पानी के साथ मिलाते हैं, तो घोल की कुल मात्रा का संकुचन होता है; यानी, अगर हम अकेले शराब और पानी की मात्रा जोड़ते हैं तो अंतिम मात्रा छोटी होगी। ऐसा इसलिए है क्योंकि अल्कोहल के अणु पानी के अणुओं के साथ बांड या हाइड्रोजन बांड स्थापित करते हैं, जिससे उनके बीच की जगह कम हो जाती है।
इसलिए, इस और अन्य मामलों में, अभ्यास में प्रदान नहीं किए जाने पर समाधान की मात्रा को प्रयोगात्मक रूप से मापा जाना चाहिए।
जैसा कि ऊपर उल्लेख किया गया है, मादक पेय और वाणिज्यिक अल्कोहल के मामलों में मात्रा के प्रतिशत का व्यापक रूप से उपयोग किया जाता है। इस गणना के दो महत्वपूर्ण अनुप्रयोग देखें:
- सांस लेने वाला यंत्र: ब्रेथ एनालाइजर रक्त में एथिल अल्कोहल की सांद्रता को मापता है, और ब्राजील में किसी के लिए भी किसी भी प्रकार के वाहन को चलाने की मनाही है जिसमें रक्त अल्कोहल की मात्रा 0.1% या उससे अधिक हो। इस अल्कोहल की मात्रा वाले व्यक्ति में, प्रत्येक लीटर रक्त के लिए, 1 एमएल अल्कोहल होता है, जैसा कि निम्नलिखित गणनाओं द्वारा दिखाया गया है:
τवी%=वी1. 100%
वी
0,1 % = वी1. 100%
1एल
वी1 = 0,1% → वी1 = 0.001 एल = 1 एमएल
100%

- गैसोलीन में इथेनॉल सामग्री: ब्राजील में, गैसोलीन को इथेनॉल के अतिरिक्त द्वारा नियंत्रित किया जाता है। लेकिन गैसोलीन में इथेनॉल की मात्रा निर्जल अल्कोहल की मात्रा से अधिकतम 24% होनी चाहिए (क्योंकि गैसोलीन पानी मुक्त होना चाहिए)। गैसोलीन में जितना अधिक इथेनॉल मिलाया जाता है, ईंधन का रंग उतना ही हल्का होता जाता है और इसका घनत्व बढ़ जाता है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "रासायनिक समाधान का आयतन शीर्षक"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm. 28 जून, 2021 को एक्सेस किया गया।
रसायन विज्ञान

ब्रीथेलाइज़र कैसे काम करता है, अल्कोहल सांद्रता, श्वासनली, एथिल अल्कोहल से संबंधित प्रतिक्रियाएं, प्रकार सांस लेने वाले, पोटेशियम डाइक्रोमेट, ईंधन सेल, उत्प्रेरक, इलेक्ट्रॉन रिलीज, एसिटिक एसिड, हाइड्रोजन, अवधारणा



