कल्पना कीजिए कि आप 20ºC पर 100 ग्राम पानी के गिलास में 10 ग्राम टेबल सॉल्ट (सोडियम क्लोराइड - NaCl) मिलाते हैं। मिलाने के बाद, आप देखते हैं कि नमक पूरी तरह से घुल गया है, इसलिए आप और भी नमक डालने का फैसला करें। कुछ बिंदु पर, आप उस मात्रा में पानी में नमक को भंग करने में सक्षम नहीं होंगे, और कोई भी जोड़ा नमक गिलास के नीचे डूब जाएगा, चाहे आप इसे मिश्रण करने की कितनी भी कोशिश कर लें।
जब ऐसा होता है, तो हम कहते हैं कि समाधान है तर-बतर और वह घुलनशीलता गुणांक. इसलिए, हम घुलनशीलता गुणांक को निम्नानुसार परिभाषित कर सकते हैं:
“घुलनशीलता गुणांक विलेय की अधिकतम मात्रा है जो किसी दिए गए तापमान पर विलायक की एक निश्चित मात्रा में घुल जाती है।"
उदाहरण के लिए, पानी में नमक का घुलनशीलता गुणांक बराबर होता है 36 ग्राम NaCl/100 ग्राम पानी 20ºC पर। पानी की इतनी मात्रा में और इस तापमान पर एक अतिरिक्त ग्राम नमक घोलना संभव नहीं है, जैसे घुलनशीलता गुणांक प्रत्येक पदार्थ के लिए विशिष्ट है। यदि हम विलेय को बदलते हैं, उदाहरण के लिए, टेबल सॉल्ट को NH. से बदलना4Cl, इसका विलेयता गुणांक के बराबर है 20 डिग्री सेल्सियस पर 100 ग्राम पानी में 37.2 ग्राम।
इसके अलावा, एक ही पदार्थ की अलग-अलग सॉल्वैंट्स में अलग-अलग घुलनशीलता होती है. जबकि नमक पानी में घुलनशील है, यह एसीटोन या एथिल एसीटेट (ग्लेज़ को हटाने के लिए इस्तेमाल किया जाने वाला विलायक) में व्यावहारिक रूप से अघुलनशील है।
एक और बात यह है कि जब भी किसी विलायक की एक निश्चित मात्रा में घुलनशीलता गुणांक का उल्लेख किया जाता है, तापमान को इंगित करना भी आवश्यक है, क्योंकि यह एक हस्तक्षेप कारक है। उदाहरण के लिए, यदि हम २० डिग्री सेल्सियस पर १०० ग्राम पानी लेते हैं और ४० ग्राम नमक मिलाते हैं, तो ३६ ग्राम घुल जाएगा और ४ ग्राम अवक्षेप बन जाएगा। लेकिन अगर हम इस घोल को गर्म करने के लिए लेते हैं, तो हम देखेंगे कि तापमान बढ़ने पर 4 ग्राम घुल जाएगा।
इससे हमें पता चलता है कि तापमान बढ़ने पर समान मात्रा में विलायक में घुलने वाले विलेय में अलग-अलग घुलनशीलता गुणांक होते हैं।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
नीचे एक उदाहरण देखें:
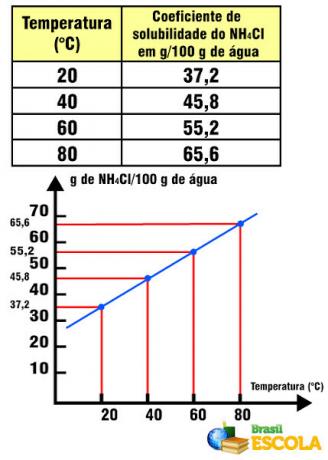
एनएच घुलनशीलता गुणांक4तापमान के संबंध में सीएल
ध्यान दें कि इस मामले में, NH. का विलेयता गुणांक4बढ़ते तापमान के साथ Cl बढ़ता है। यह पानी में अधिकांश लवणों के साथ होता है। हालांकि, ऐसी स्थितियां हैं जिनमें बढ़ते तापमान के साथ घुलनशीलता गुणांक कम हो जाता है, जैसा कि Ce. के मामले में होता है2(केवल4)3. ऐसे मामले भी हैं जिनमें घुलनशीलता गुणांक में ऐसी कोई उल्लेखनीय परिवर्तनशीलता नहीं है, जैसा कि टेबल सॉल्ट के साथ होता है। इसे पाठ में देखें घुलनशीलता वक्रों के रेखांकन.
यह हो सकता है कि हम कुछ विशिष्ट स्थितियों में, विलेय की मात्रा को उसके विलेयता गुणांक से अधिक विलायक में घोल सकते हैं, इस प्रकार तथाकथित प्राप्त कर सकते हैं अतिसंतृप्त विलयन। उदाहरण के लिए, कल्पना करें कि 20 डिग्री सेल्सियस पर 100 ग्राम पानी और 40 ग्राम टेबल सॉल्ट (36 ग्राम के साथ) के साथ एक घोल बनता है। भंग और 4 ग्राम अवक्षेपित), तब तक गर्म किया जाता है जब तक कि यह उस तापमान तक नहीं पहुंच जाता जिस पर सभी विलेय अपने आप को घोलना। फिर, इस घोल को आराम करने के लिए छोड़ दिया जाता है ताकि यह कमरे के तापमान तक ठंडा हो जाए, जो कि 20ºC के करीब है।
यदि घोल में कोई गड़बड़ी नहीं है, तो अतिरिक्त विलेय घुला रहेगा, इस प्रकार एक सुपरसैचुरेटेड घोल बनता है। हालांकि, इस प्रकार का समाधान बहुत अस्थिर है, और किसी भी अचानक आंदोलन से उस तापमान के लिए घुलनशीलता गुणांक से ऊपर की मात्रा क्रिस्टलाइज हो सकती है। इस प्रकार, जो समाधान था अतिसंतृप्त हो जाएगा पृष्ठभूमि शरीर के साथ संतृप्त.
एक आखिरी मामला है असंतृप्त विलयन, जो तब होता है जब घुले हुए विलेय की मात्रा विलेयता गुणांक के मान से कम होती है। एक उदाहरण 20 डिग्री सेल्सियस पर 100 ग्राम पानी में 10 ग्राम NaCl का विघटन है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "घुलनशीलता गुणांक"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm. 28 जून, 2021 को एक्सेस किया गया।


