O équilibrer une équation d'oxydo-réduction il est basé sur l'égalité du nombre d'électrons distribués avec le nombre d'électrons reçus. Une méthode simple pour effectuer cet équilibrage est donnée par les étapes suivantes :
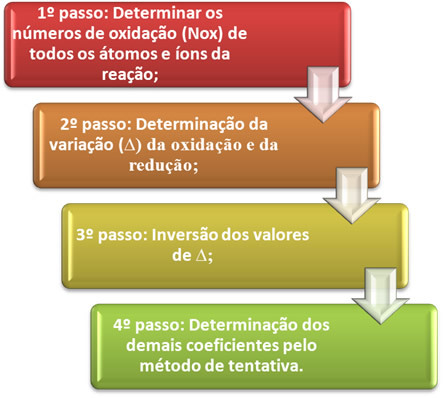
Voyons en pratique comment appliquer ces étapes, à travers l'exemple suivant :
Réaction entre une solution aqueuse de permanganate de potassium et d'acide chlorhydrique :
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*1ère étape:Déterminer les nombres d'oxydation :
Cette étape est importante car nous ne pouvons généralement pas visualiser rapidement quelles espèces subissent une oxydation et une réduction.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*2ème étape :Détermination de la variation d'oxydation et de réduction :

Notez que le manganèse (Mn) est réduit et le chlore (Cl) est oxydé.
MnCl2 = ∆Nox = 5
Cl2 = Nox = 2
Dans le cas du chlore, on peut noter que HCl a donné naissance à 3 composés (KCl, MnCl2, et Cl2), mais ce qui nous intéresse c'est la Cl2, car c'est votre Nox qui a subi des variations. Chaque chlore qui forme Cl
2 perdre 1 électron; car il faut 2 chlores pour former chaque Cl2, alors deux électrons sont perdus.3ème étape :Inversion des valeurs de :
Dans cette étape, les valeurs de ∆ sont échangées entre les espèces mentionnées, devenant leurs coefficients :
MnCl2 = ∆Nox = 5 → 5 sera le coefficient de Cl2
Cl2 = ∆Nox = 2→ 2 sera le coefficient de MnCl2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
A ce stade, il est déjà possible de connaître deux coefficients de l'équation.
Observation: normalement, dans la plupart des réactions, cette inversion des valeurs est effectuée sur le 1er membre. Mais, en règle générale, cela devrait être fait dans le membre qui a le plus grand nombre d'atomes qui subissent un redox. Si ce critère ne peut pas être rempli, nous inversons les valeurs pour le membre avec le plus grand nombre d'espèces chimiques. C'est ce qui a été fait ici, car le 2ème membre a plus de substances.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
4ème étape : Équilibrage d'essai :
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Comme dans le second membre il y a deux atomes de manganèse, comme le montre le coefficient, dans le premier il doit aussi y en avoir. Donc nous avons:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5cl2 + H2O
- Ainsi, la quantité de potassium (K) dans le 1er membre était de 2, ce qui sera le même coefficient pour cet atome dans le second membre :
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- La quantité de chlore (Cl) dans le 2ème membre est de 16 au total, donc le coefficient HCl du 1er membre sera :
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Le nombre d'hydrogènes dans le 1er membre est de 16, d'où le coefficient de l'eau (H2O) du 2ème membre sera égal à 8, puisque la multiplication de l'indice d'hydrogène (2) par 8 est égale à 16 :
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Pour vérifier si l'équation est correctement équilibrée, nous pouvons voir deux critères :
1er) Vérifiez si la quantité de chaque atome dans les deux membres est égale :
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5cl2 + 8H2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
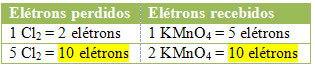
2e) Voir si le nombre total d'électrons perdus est égal au nombre total d'électrons reçus :
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Equilibrage Roxi-réduction »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Consulté le 28 juin 2021.