La théorie de l'hybridation est apparue comme un complément à la Théorie de l'octet, réussissant à expliquer la structure d'un plus grand nombre de molécules, dont des molécules formées par le bore (B).
Cet élément a cinq électrons à l'état fondamental, avec la configuration électronique suivante :
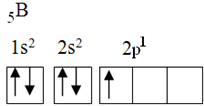
Selon la théorie de l'octet, le bore ne pourrait faire qu'une seule liaison covalente, car il n'a qu'une orbitale atomique incomplète. Cependant, expérimentalement, on constate que cet élément forme des composés dans lesquels il réalise plus d'une liaison.
Un exemple est le trifluorure de bore (BF3). Comme indiqué ci-dessous, le bore fait trois liaisons covalentes avec le fluor, partageant trois paires de électrons et ayant six électrons dans sa dernière couche (couche de valence), c'est-à-dire une exception à la règle de octuor.
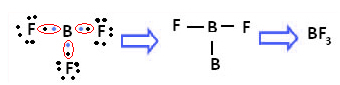
Ceci s'explique par le phénomène d'hybridation qui se produit avec le bore. Il s'avère qu'un électron du sous-niveau 2s absorbe de l'énergie et passe à l'état excité, dans lequel il saute dans une orbitale vide du sous-niveau 2p. De cette façon, trois orbitales incomplètes sont formées, qui peuvent maintenant faire trois liaisons covalentes :
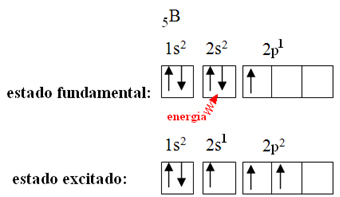
Cependant, les liaisons formées dans le trifluorure de bore sont toutes les mêmes, mais si on regarde ci-dessus, il y a deux liaisons différent, puisque l'un d'eux serait fait au moyen d'une orbitale s et les deux autres au moyen d'une orbitale du type. tapez p. C'est là que l'hybridation a lieu, c'est-à-dire que les orbitales incomplètes fusionnent, donnant lieu à trois orbitales hybrides ou alors hybridé, identiques et différents des originaux :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
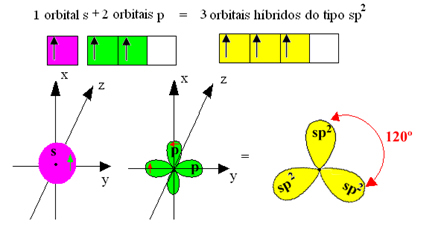
Étant donné que ces orbitales hybrides se composent d'une orbitale s et de deux orbitales p, cette hybridation est appelée hybridation sp².
Le fluor qui se lie au bore a neuf électrons. Sa distribution électronique et ses orbitales sont indiquées ci-dessous :
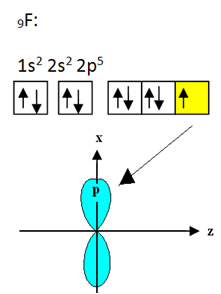
A noter que chaque atome de fluor ne peut faire qu'une seule liaison covalente et que l'orbitale qui fait cette liaison est de type p. Alors, observez ci-dessous comment se forment les orbitales lors de l'établissement des connexions qui forment le BF3 et voyez comment les liens sont identiques, comme σp-sp2:
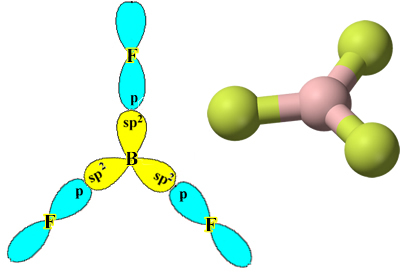
Cela se produit également avec d'autres éléments, voir, par exemple, le texte "Hybridation du béryllium”.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « hybridation du bore »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm. Consulté le 28 juin 2021.