LES pont de sel a été proposé par le chimiste anglais Frederic Daniell, en 1836, lorsque ce savant a créé le la batterie nommé d'après lui (la Pile de Danill). ce pont est un tube en forme de U qui a deux extrémités poreuses. (constitué de coton ou d'agar-agar) et contient une solution aqueuse formée d'eau et d'un sel. Il relie indirectement les solutions des deux demi-cellules de la cellule (l'anode et la cathode).
Observation: L'anode est le pôle négatif de la batterie et c'est là que se produit l'oxydation, et la cathode est le pôle positif et où se produit la réduction.
Pour comprendre l'importance du pont salin, il faut d'abord comprendre le fonctionnement de la pile. Voir le schéma ci-dessous :
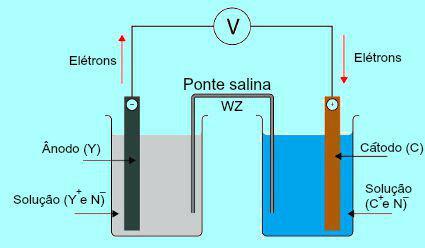
Schéma général d'une pile Daniell
Initialement, le métal (Y) de la plaque présente dans l'anode subit une oxydation. Lors de l'oxydation, le métal se transforme en cation, qui tombe dans la solution dans laquelle se trouve la plaque. Pour cette raison, la solution anodique commence à présenter une concentration plus élevée de cations (Y
+). Dans ce cas, une diminution de la plaque métallique de l'anode est observée.
O → et- + O+
Ensuite, les électrons perdus lors de l'oxydation du métal de la plaque anodique parcourent le fil électrique externe et se dirigent vers la plaque métallique présente dans la cathode. Ainsi, la plaque présente à la cathode se charge d'électrons.
-
Les cations présents (C+) dans la solution se déplacent vers la plaque cathodique car elle est chargée d'électrons. Les cations, en gagnant les électrons présents dans la plaque, deviennent neutres (stables et solides) et y adhèrent. Pour cette raison, la solution cathodique présente une concentration plus élevée d'anions que de cations. Dans ce cas, une augmentation de la taille de la plaque métallique cathodique est observée.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Ç+ + et- → C
De la compréhension de la façon dont le Le tas de Daniell, il est possible d'observer que la solution présente dans l'anode reçoit une plus grande quantité de cations Y+ due à l'oxydation du métal de la plaque X. La solution présente dans la cathode, par contre, perd ses cations (C+) car ils souffrent d'une réduction de la plaque.
C'est précisément sur cette question que le travail du pont salin est mis en lumière. La fonction principale de ce pont est de favoriser l'équilibre des charges présentes à la fois dans les solutions anodique et cathodique. Dans le pont salin, nous avons toujours un sel (généralement du chlorure de potassium ou du nitrate d'ammonium.) dissocié dans l'eau. Voir la représentation d'une équation dans le pont salin :
WZ + H2O → O+ + Z-
Dans le pont salin, il y a deux ions (W+ et Z-), qui sont décalés vers la cathode et l'anode selon :
Le) L'anode reçoit les anions (Z-) présent dans le pont salin en raison de l'oxydation de l'élément (Y), ce qui provoque une augmentation de la quantité de cations (Y+) dans la solution.
B) La cathode reçoit des cations (W+) du pont salin car, en fonctionnement batterie, le cation (C+) présent dans la solution est réduit sur la carte. Ainsi, la solution cathodique a une plus grande quantité d'anions (N-) et reçoit donc le cation présent dans le pont salin.
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Pont de voile"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Consulté le 28 juin 2021.

