Acides sont des substances qui ioniser en milieu aqueux et sont bons conducteurs Puissance. L'acidité d'une substance peut être mesurée par des techniques de mesure du potentiel ionique de l'hydrogène (pH) d'une solution. Certaines méthodes d'analyse du pH utilisent des indicateurs tels que le tournesol ou la phénolphtaléine, qui reflètent la valeur du pH de la solution en couleur.
Les acides peuvent être caractérisés :
par la présence ou non d'oxygène dans sa molécule ;
de force;
par des hydrogènes ionisables ;
par sa volatilité.
A lire aussi :Comparaison entre acides et bases - différences et propriétés
Caractéristiques des acides
Ils s'ionisent en milieu aqueux, libérant le cation H+.
Ils sont conducteurs d'électricité en raison de la libération de ions en milieu aqueux.
Au contact de l'environnement de base, ils souffrent réaction de neutralisation, formant du sel et de l'eau comme produits de cette réaction.
Ils changent la couleur de la solution en présence d'une substance indicatrice telle que le tournesol ou la phénolphtaléine.
La saveur acide du citron, de l'orange, entre autres agrumes, est due à l'acide présent dans ces aliments.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Potentiel hydrogène (pH)
Le potentiel d'ions hydrogène (pH) est un calcul qui exprime le concentration en ions de hydrogène dans un certain solution. Pour déterminer le pH et analyser le milieu, les éléments suivants sont pris en compte :
la loi de dilution d'Ostwald (plus il y a de dilution, plus il se forme d'ions dans la solution) ;
l'autoionisation de l'eau (Kw), qui est la décomposition naturelle de la molécule H2O dans les ions H+ et oh-;
l'eau distillée à 25°C a une autoionisation Kw = 10-14 et même concentration d'ions H+ et oh-, c'est-à-dire que c'est un milieu neutre.
Pour le calcul du pH impliquant la concentration en H+, utiliser: pH = -log[H+].
Sachez que:
pH > 7 → solution basique
pH < 7 → solution acide
pH = 7 ou pH = pOH → solution neutre
Voir aussi: A quoi ressemblent les formules acides ?

Classification des acides
LES classification acide peut être fait en tenant compte de quatre critères différents.
Degré d'ionisation (α) ou force acide
α = nombre de molécules ionisées
nombre de molécules dissoutes
Acides forts : α ≥ 50%.
Exemple: áacide sulfurique (H2SEUL4) → α = 61%.Acides semi-forts ou modérés : 5% < α < 50%.
Exemple: acide phosphorique (H3POUSSIÈRE4) → α = 27%.Acides faibles: α ≤ 5%.
Exemple: acide borique (H3BO3) → α = 0,075%.
→ Nombre d'hydrogène ionisable
monoacide: libère un cation H+.
Exemple: áacide chlorhydrique (HCL);
diacide: libère deux cations H+.
Exemple: sulfure d'hydrogène (H2S).Triacide: libère trois cations H+.
Exemple: acide borique (H3BO3).tétracide: libère quatre cations H+.
Exemple: acide pyrophosphorique (H4P2O7).
Attention! Dans le cas des hydracides, tous les hydrogènes de la molécule sont ionisables; mais dans le cas des oxyacides, seuls les hydrogènes liés à un atome d'oxygène sont ionisables. Un exemple est l'acide hypophosphoreux (H3POUSSIÈRE2), qui est un monoacide car, malgré trois hydrogènes dans sa composition, il ne libère que l'hydrogène lié au oxygène.
→ Présence d'oxygène
oxyacides: ont de l'oxygène dans leur structure.
Exemple: acide hypochloreux (HO Cl).
Hidracides: n'ont pas d'oxygène dans leur structure.
Exemple: acide fluorhydrique (HF).
→ Volatilité
Fixé: point d'ébullition(LE PIED) > 100°C, passant lentement à l'état gazeux.
Exemple: acide sulfurique (H2SEUL4) → PE = 340 °C.volatiles: point d'ébullition < 100°C, passant rapidement et facilement à l'état gazeux.
Exemple: sulfure d'hydrogène (H2S) → PE = -59,6°C.
Nomenclature des acides
→ Hidracides
Acide + nom de l'anion + hydrique
Pour tous les acides, le terme « acide » est utilisé avant la nomenclature qui caractérise la molécule. Dans les hydracides, le suffixe « eto » du nom de l'élément est remplacé par « hydric ».
Exemples:
HCl → acide chlorehydrique
HBr → acide bromehydrique
HF → acide fluorhydrique
→ oxyacides
La nomenclature des oxyacides varie selon les indice d'oxydation (NOX) de l'élément central. Voir le tableau ci-dessous :
NOX de l'élément central |
Nomenclature des acides |
||
préfixe- |
-infixe- |
-suffixe |
|
+1 et +2 |
Hippopotame- |
-nom de l'anion- |
-oso |
+3 et +4 |
-- |
Nom de l'anion- |
-oso |
+5 et +6 |
-- |
Nom de l'anion- |
-ic |
+7 |
Par |
-nom de l'anion- |
-ic |
Exemples:
HClO → Sachant que l'hydrogène (H) a normalement NOX +1 et l'oxygène (O) a NOX -2, pour que nous ayons une molécule de charge 0, le chlore (Cl) doit avoir NOX +1, donc la nomenclature de cet acide est acide hypochloreux.
HNO2 → acide nitreux
HClO4 →áacideperchlorique
→ Exceptions à la règle
H2CO3 → acide carbonique, et non carbonée, comme ce serait le cas en vertu de la règle NOX.
H3BO3 → áacide borique, et pas ennuyeux.
Les acides au quotidien
Engrais et médicaments : Acide phosphorique (H3POUSSIÈRE4) est largement utilisé dans la fabrication d'engrais et également comme médicament. C'est l'un des nombreux acides utilisés dans le domaine pharmaceutique.
Les agrumes: avoir de l'acide ascorbique (C6H8O6), aussi connu sous le nom Vitamine C.
Le vinaigre: a dans sa composition Acide acétique (CH3COOH).
- Eau gazeuse et boissons gazeuses : composé d'acide carbonique (H2CO3), ce qui donne au produit une sensation rafraîchissante.
Accédez également à :Rôle des acides dans les boissons gazeuses

exercices résolus
Question 1 - (Enem) Le jus extrait du chou rouge peut être utilisé comme indicateur du caractère acide (pH entre 0 et 7) ou basique (pH entre 7 et 14) de différentes solutions. En mélangeant un peu de jus de chou et la solution, le mélange commence à montrer des couleurs différentes, selon son caractère acide ou basique, selon l'échelle ci-dessous.
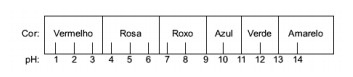
Certaines solutions ont été testées avec cet indicateur, produisant les résultats suivants :
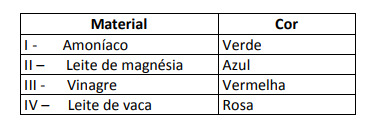
D'après ces résultats, les solutions I, II, III et IV ont respectivement le caractère suivant :
A) acide / basique / basique / acide.
B) acide/basique/acide/basique.
C) basique / acide / basique / acide.
D) acide/acide/basique/basique.
E) Basique / Basique / Acide / Acide.
Résolution
Alternative E. Pour déterminer si la substance a un caractère acide, basique ou même neutre, une analyse des couleurs obtenues dans le test est effectuée par rapport aux données de l'échelle donnée. Sachant que les solutions avec pH = 7 sont neutres, pH > 7 sont basiques et avec pH < 7 sont acides, on arrive à conclusion que l'ammoniac et le lait de magnésie sont des substances basiques, et que le vinaigre et le lait de vache sont acides.
Question 2 - (PUC-Camp) Concernant les substances dites acides, un étudiant a noté les caractéristiques suivantes :
I - ont un pouvoir corrosif;
II - sont capables de neutraliser les bases;
III - sont composés de deux éléments chimiques ;
IV - former des solutions aqueuses conductrices de courant électrique.
Il a fait des erreurs UNIQUEMENT dans
A) I et II
B) I et III
C) I et IV
D) II et III
E) III et IV
Résolution
Variante B. Tous les acides ne sont pas corrosifs, seuls les plus forts, et les acides peuvent être composés de deux atomes ou plus.
par Laysa Bernardes
Professeur de chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
ARAúJO, Laysa Bernardes Marques de. « Acides »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/acidos.htm. Consulté le 27 juin 2021.


