Enzymes sont des catalyseurs biologiques responsables de l'augmentation de la vitesse d'une réaction chimique donnée. Les enzymes sont généralement protéines, mais il y en a acides ribonucléiques qui agissent comme des enzymes, étant appelés ribozymes.
Afin d'accélérer une réaction, les enzymes doivent se lier à des réactifs, appelés substrats. Pendant longtemps, on a cru que ce lien se produisait de manière très rigide, un modèle connu sous le nom de serrure à clé. à l'heure actuelle, Pourtant, le modèle dit d'ajustement induit est accepté., ce qui suppose que de légers changements se produisent dans la forme de l'enzyme lorsque le substrat pénètre dans le site actif.
A lire aussi: Qu'est-ce que le métabolisme ?
Que sont les enzymes ?
Les enzymes sont des biomolécules qui agissent comme des catalyseurs, c'est-à-dire qu'elles sont substances capables d'accélérer la vitesse de réactions chimiques qui se produisent chez les êtres vivants sans être consommés lors de ces réactions. Sans l'action des enzymes, certaines réactions seraient très lentes, ce qui nuirait au métabolisme. Les enzymes accélèrent sélectivement les réactions et sont donc des catalyseurs très spécifiques.
Les enzymes sont capables d'accélérer une réaction en diminuant l'énergie d'activation, c'est-à-dire qu'elles réduisent la quantité d'énergie qui doit être ajoutée pour qu'une réaction démarre.
[publication_omnia]
Chaque enzyme est-elle une protéine?
Bien qu'ils soient souvent définis comme des catalyseurs biologiques de nature protéique, toutes les enzymes ne sont pas des protéines. Certains ARN fonctionnent comme des enzymes, appelés ribozymes. La plupart des enzymes, cependant, sont des protéines, étant formées, par conséquent, par acides aminés. La composition en acides aminés de ces biomolécules définit la structure tridimensionnelle qu'elle va acquérir.
A lire aussi: Comment fonctionnent les substances catalytiques ?
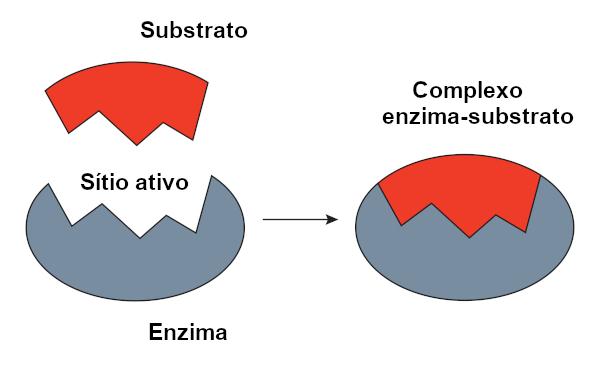
Complexe Enzyme-Substrat
C'est ce qu'on appelle le substrat réactif sur lequel agit une enzyme. Lorsqu'une enzyme se lie à son substrat, le complexe se forme substrat enzymatique. Cette liaison a lieu dans une région spécifique, appelée site actif.
Lorsqu'on parle d'enzymes à base de protéines, le site actif correspond à quelques acides aminés, le reste de la molécule étant chargé de déterminer la configuration du site actif. La forme du site actif ainsi que la forme du substrat sont liées à la spécificité de l'enzyme, car elles doivent être complémentaires.
Modèle à clé
O modèle de serrure à clé, proposé par Emil Fischer, est largement utilisé pour expliquer l'interaction entre l'enzyme et le substrat. Selon ce modèle, il existe une complémentarité rigide entre l'enzyme et le substrat, tout comme une clé et une serrure. Le site actif de l'enzyme aurait une forme complémentaire au substrat, qui s'adapterait parfaitement. D'autres molécules n'auraient donc pas accès à ce site, ce qui garantirait la spécificité de l'enzyme. Tout comme une clé n'ouvre qu'une serrure, une enzyme ne se lierait qu'à un substrat. Aujourd'hui, nous savons cependant que cette le modèle n'est pas correct, puisque les enzymes ne sont pas des structures rigides comme on le pensait auparavant.
Modèle d'ajustement induit
Actuellement, le modèle le plus accepté pour expliquer le lien entre une enzyme et son substrat est celui de se casser induit, initialement proposé par Koshland et al. Le site actif et le substrat ne fonctionnent pas de manière rigide comme une clé et une serrure. La recherche montre que lorsque le substrat pénètre dans le site actif, l'enzyme subit une légère modification, ce qui favorise l'ajustement entre le site actif et le substrat. Pour mieux comprendre ce modèle, nous pouvons considérer l'interaction enzyme et substrat comme une poignée de main, qui devient plus ferme après le premier contact.
Cofacteurs
La plupart des enzymes ont besoin de molécules auxiliaires pour exercer leur action catalytique, appelées cofacteurs. Les cofacteurs peuvent être attachés de façon permanente à l'enzyme ou peuvent être faiblement et réversiblement attachés au substrat. Ils aussi peut être inorganique ou organique. Lorsque les cofacteurs sont des molécules organiques, ils sont appelés coenzymes.
Quelque vitamines agissent comme des coenzymes, c'est le cas par exemple de la riboflavine, également appelée vitamine B2. A titre d'exemples de cofacteurs inorganiques, on peut citer le fer et le zinc sous leur forme ionique.
A lire aussi: Vitamines du complexe B - un groupe de vitamines qui agissent généralement comme des coenzymes
Classification des enzymes
Les enzymes peuvent être classées en six groupes, en utilisant comme critère le type de réaction qu'ils catalysent.
Oxydoréductases: enzymes liées aux réactions de oxyderréduction.
Transferts : catalyser le transfert de groupes d'un composé à un autre.
Hydrolases : catalyser les réactions d'hydrolyse.
Liaisons: agir en ajoutant des groupes à des doubles liaisons ou en supprimant des groupes formant une double liaison.
Isomérases : catalyser les réactions d'isomérisation.
Liens: enzymes qui provoquent la dégradation de la molécule de ATP, en utilisant l'énergie libérée dans cette réaction pour former de nouveaux composés.
Facteurs qui régulent l'activité enzymatique
L'activité d'une enzyme est influencée par des facteurs, les principaux étant la température et la pH. La température joue généralement un rôle positif dans les réactions chimiques, augmentant la vitesse d'une réaction enzymatique. Cependant, lorsque le Température augmente au-dessus des conditions optimales, la vitesse de réaction diminue considérablement. En effet, la dénaturation des protéines est observée. La plupart des enzymes humaines ont une température optimale entre 35 et 40 ºC. En plus de la température, le pH il influence également l'activité enzymatique, et il existe également une valeur optimale. Pour la plupart des enzymes, la valeur de pH optimale se situe entre 6 et 8.
Par Vanessa Sardinha dos Santos
Professeur de biologie

