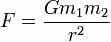Pour classer un lien sigma, il est essentiel de savoir le reconnaître dans la structure d'une molécule. La liaison sigma est en fait une liaison covalente qui se produit lorsque deux orbitales atomiques incomplètes (avec un seul électron) interpénétrer sur le même axe. Un exemple est lorsqu'une orbitale de type p (hélice) s'interpénètre avec une autre orbitale p.

orbitales p s'interpénétrant dans une liaison p-p sigma
En pratique (en exercices), la reconnaissance et la classification d'un lien sigma se font à partir de la formule structurelle d'une substance, comme dans la représentation structurelle ci-dessous :

Formule développée de l'acide cyanhydrique
Avant de classer un lien sigma, il faut savoir le reconnaître dans une formule structurale. Pour cela, n'oubliez pas le des manières comme un une liaison covalente est représenté: l'appel Facile est représenté par un seul tiret (-), le paire est représenté par deux (=) et le lien tripler est représenté par trois (≡). La liaison sigma est présente dans l'une des trois représentations des liaisons covalentes comme suit :
Simple: a une liaison sigma ;
Paire: Des deux liens, un seul est sigma ;
Tripler: L'un des trois liens est sigma.
Sachant reconnaître un lien sigma, l'étape suivante consiste à apprendre à le classer. Pour cela, il faut savoir quelle est l'orbitale incomplète de chaque atome impliqué dans la liaison :
H - présente l'orbitale s incomplète, ainsi, dans la classification, elle est représentée par s.
Amétaux- ont une orbitale p incomplète, donc, dans la classification, elles sont représentées par p, à l'exception des éléments suivants :
Carbone: Votre orbitale incomplète dépend du type de hybridation qu'il souffre. Les possibilités sont: hybridation sp3 (combien fait-il quatre appels simples), sp2 (combien cela fait-il deux liaisons simples et une double liaison) ou sp (combien il réalise deux doubles liaisons ou une simple et une triple). Ainsi, dans la classification d'une liaison sigma, le carbone peut être représenté par sp3, sp2 ou sp en fonction de l'appel que vous passez.
Béryllium:souffrir hybridation de type sp, ainsi, dans la classification, est représenté par sp.
Bore:souffrir hybridation de type sp2, ainsi, dans la classification, il est représenté par sp.2.
Avec toutes ces informations, le plus simple est de classer les liens sigma présents dans une structure. Voyons quelques exemples :
Exemple 1: connexions sigma dans l'eau

Formule structurelle de l'eau
La formule structurelle ci-dessus montre que l'eau a deux liaisons sigma (deux simples), étant entre l'oxygène (représenté par p) C'est le Hydrogène (représenté par s). Ainsi, nous avons deux liens sigma classés en :
s-p
Exemple 2: Liaisons Sigma dans le trichlorure de phosphore

Formule développée du trichlorure de phosphore
La formule développée ci-dessus montre que le trichlorure de phosphore a trois appelssigma (trois simples), étant entrer dans le phosphore (représenté par p) C'est le chlore (représenté par p). Ainsi, nous avons trois liens sigma classés en :
p-p
Exemple 3 : liaisons sigma dans le trifluorure de bore
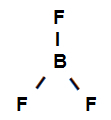
Formule développée du trifluorure de bore
La formule structurelle ci-dessus montre que le trifluorure de bore a trois liens sigma (trois simples), étant entrer dans le bore (représenté par sp2) C'est le Fluor (représenté par p). Ainsi, nous avons trois liens sigma classés en :
p-sp2
Exemple 4 : liaisons sigma dans l'éthanol
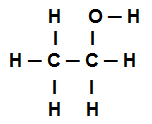
Formule développée de l'éthanol
La formule structurelle de l'éthanol ci-dessus montre que nous avons la présence de huit appels sigmas (huit liens simples). Sont-ils:
Un parmi les Oxygène (représenté par p) et l'hydrogène (représenté par s). Ainsi, le lien est classé en sigma s-p.
L'un des deux carbones qui n'effectuent que des connexions sigma (puis représenté par sp3). Ainsi, le lien est classé en sp3-P3.
Un parmi les Carbone (représenté par sp3) et l'oxygène (représenté par p). Ainsi, le lien sigma est classé en p-sp3.
cinq entre le carbone (représenté par sp3) et l'hydrogène (représenté par s). Ainsi, tous les cinq sont classés en s-sp3.
Exemple 5 : Liaisons Sigma dans le dichloroéthène

Formule développée du dichloroéthène
La formule structurelle du dichloroéthène ci-dessus montre que nous avons la présence de cinq liens sigma (les quatre liaisons simples et une des doubles liaisons). Sont-ils:
L'un des deux carbones qui effectuent deux liaisons simples et une double liaison (puis représenté par sp2). Ainsi, le lien sigma est classé en sp2-P2.
Quatre sont entre le carbone(représenté par sp2)et l'hydrogène (représenté par s). Ainsi, tous les quatre sont classés en s-sp2.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm