O benzène est un composé organique classé comme hydrocarbure aromatique. Il est largement utilisé comme matière première dans les industries, dans les procédés de laboratoire, dans les entreprises sidérurgiques et dans les industries pétrochimiques pour le raffinage du pétrole.
A lire aussi: Le méthane — le plus petit et le plus simple des hydrocarbures
Formule
Le benzène est un composé de formule moléculaire Ç6H6et qui a un structure extrêmement stablel. La formule structurelle du benzène est représentée comme suit :
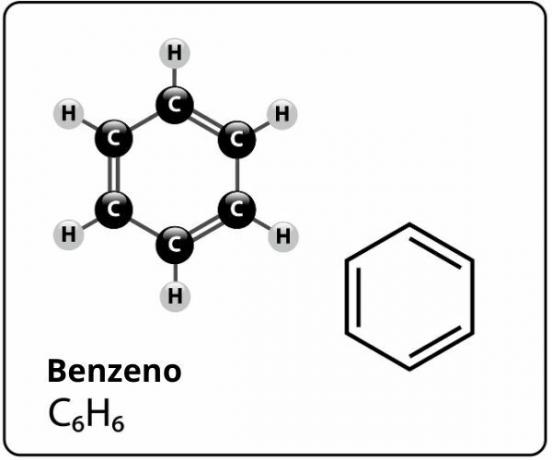
Qui a proposé cette structure pour le benzène avec six atomes de carbone liés entre eux par des doubles liaisons alternées, formant un hexagone et ayant attaché à chacun d'eux un atome de hydrogène, c'était le chimiste allemand Friedrich August Kekule, en 1866.
Le benzène subit un phénomène appelé résonance, dans lequel les électrons dans les liaisons entre les carbones diffèrent par leur position. Pour cette raison, le benzène peut être représenté comme suit :
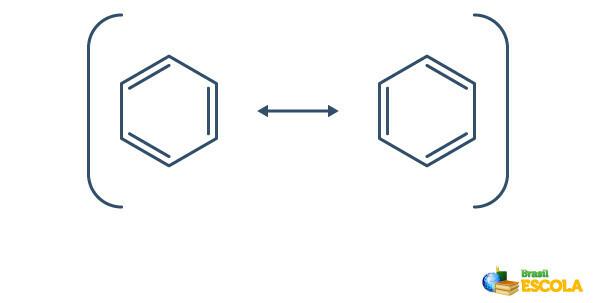
La structure réelle du benzène est un intermédiaire entre les structures de résonance illustrées ci-dessus. Cela ne veut pas dire que le benzène apparaît parfois sous une forme, parfois sous l'autre, ni que les deux formes existent en même temps. Nous représentons le benzène comme suit :
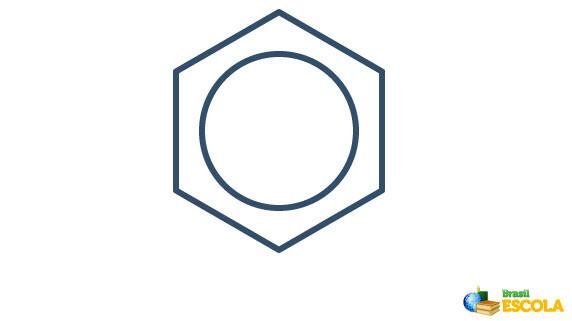
Le cercle à l'intérieur de l'hexagone représente la résonance entre les électrons dans les liaisons.
Caractéristiques
- Le benzène est un liquide incolore, inflammable c'est courant arôme agréable caractéristique.
- Formule moléculaire: C6H6.
- Masse molaire: 78,11 g/mol.
- Densité: 0,876 g/cm³.
- Température de fusion: 5,5 °C.
- Température d'ébullition: 80,1 ºC – sa faible température d'ébullition explique sa grande volatilité (facilité à s'évaporer).
Le benzène est un substance toxique et ses vapeurs peuvent provoquer des étourdissements, des maux de tête et des évanouissements.
A lire aussi :Monoxyde de carbone — gaz extrêmement toxique, incolore et inodore
Applications et toxicité du benzène
le benzène est principalement utilisé comme matière première dans les industries de production d'autres substances, telles que les plastiques et polymères à base de styrène, résines, adhésifs, nylon, caoutchoucs, lubrifiants, pesticides, etc.
Le benzène a été remplacé, principalement dans les laboratoires, par le toluène, qui a une polarité et solubilité similaires à celles du benzène, mais il est moins toxique et avec une température d'ébullition plus élevée.
Le benzène fait partie du groupe des substances chimiques considérées comme cancérigènes, causant des dommages à la moelle osseuse et la leucémie, lorsqu'il est exposé à long terme à des concentrations élevées. À court terme, le benzène peut provoquer des étourdissements, de la somnolence, des battements cardiaques rapides, des convulsions et des évanouissements.
Comme il s'agit d'un liquide volatil, le benzène libère facilement des gaz et, par conséquent, la contamination par le benzène se produit principalement par les voies respiratoires.
Où trouve-t-on du benzène ?
La plupart du benzène rejeté dans l'environnement résulte de l'action humaine, principalement dans les activités industrielles, mais il peut également être libéré comme sous-produit d'incendies et d'activités volcaniques.
le benzène est l'une des substances constitutives de Pétrole et est présent dans l'essence, étant libéré dans l'atmosphère par la combustion de carburants automobiles. En outre, on le trouve également dans les boissons gazeuses et les cigarettes.

Polarité
Le benzène est un molécule non polaire, comme tout le monde Hydrocarbures et présente donc très faible solubilité dans l'eau (0,8 g/L à 15°C). Dans certaines procédures de laboratoire, le benzène est utilisé comme solvant organique pour les substances non polaires.
Nomenclature
Il existe une règle appliquée uniquement à la nomenclature des composés aromatiques, c'est-à-dire ceux qui ont du benzène dans leur structure. Cette règle est divisée en deux cas, qui dépendent de la quantité de radicaux attachés au cycle benzénique.
1er CAS: lorsqu'il n'y a qu'un seul radical attaché au cycle benzénique, le nom est donné suivant la règle suivante :
NOM RADICAL + BENZÈNE
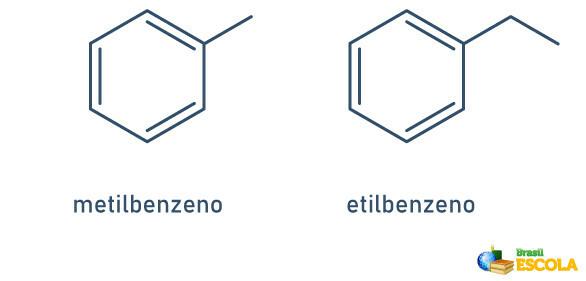
Notez qu'il n'est pas nécessaire d'indiquer la position de la tige.
2ème CAS: lorsqu'il y a plus d'un radical attaché au benzène, le nom suit la règle suivante :
POSITION RADICALE + NOM RADICAL + BENZÈNE
Voir l'exemple :

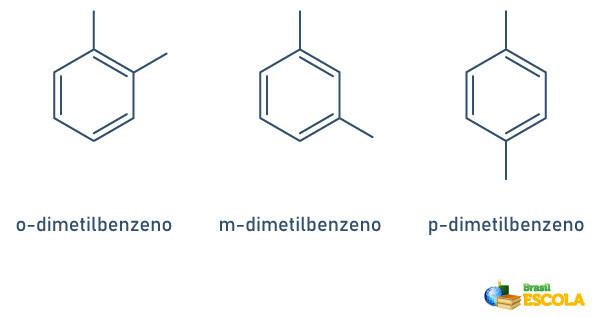
Lorsque le cycle benzénique n'a que deux radicaux attachés, il existe une nomenclature spécifique qui peut être utilisée :
- 1,2 ou ortho(o);
- 1,3 ou but (m);
- 1.4 ou à (p).
Voir les exemples :
A lire aussi: Nitrate d'ammonium — composé hautement réactif utilisé dans la fabrication d'explosifs
Curiosités
- Le benzène est une substance extrêmement cancérigène, en cours de classification par l'Agence internationale de la recherche sur le cancer, dans le groupe 1, avec le tabac, la fumée de diesel et la viande traité.
- Il existe plusieurs organismes de réglementation qui limitent l'exposition et les émissions de benzène dans différents pays. Au Brésil, ce rôle est de la responsabilité d'Anvisa.
- Avant de connaître ses risques, le benzène était utilisé en cosmétique, comme l'après-rasage, en raison de son odeur agréable.
Par Victor Ricardo Ferreira
Professeur de chimie

