LES géométrie angulaire est l'un des nombreux types de géométrie moléculaire, qui peut encore être linéaire, pyramidale, trigonale plate, tétraédrique, etc. La géométrie angulaire ne peut être trouvée que dans les molécules qui ont les caractéristiques suivantes :
Les triatomiques, c'est-à-dire qu'ils n'ont que trois atomes ;
Avoir au moins trois nuages d'électrons dans l'atome central.
Noter: le cloud électronique est tout une liaison covalente (simple, double, triple ou coordonné) entre les atomes et les paires d'électrons du couche de valence qui ne participent pas à un appel.
Voir quelques exemples de molécules qui ont une géométrie angulaire :
1er exemple : eau (H2O)

structure d'eau conventionnelle
Dans la structure de l'eau, on a :
Trois atomes: deux hydrogènes et un oxygène ;
L'oxygène est l'atome central car il fait un plus grand nombre de liaisons (deux, car il appartient à la famille VIA) ;
Deux liaisons simples entre l'oxygène et les hydrogènes. C'est parce que chaque hydrogène ne peut faire qu'une liaison et l'oxygène deux liaisons ;
Quatre électrons non liants dans l'oxygène, car il a six électrons dans la couche de valence et n'en utilise que deux dans les liaisons.
Par conséquent, comme dans la molécule d'eau, il y a trois atomes et quatre nuages électroniques (deux liaisons simples et deux paires d'électrons non liés) dans l'atome central, le la géométrie est angulaire.
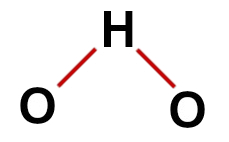
Formule structurelle correcte de l'eau
Noter: Chaque fois que la molécule présente ces motifs, l'angle formé entre les atomes est d'environ 109º 28'.
2e exemple : Dioxyde de soufre (SO2)

Structure conventionnelle du dioxyde de soufre
Dans la structure du dioxyde de soufre, nous avons :
Trois atomes: deux oxygènes et un atome de soufre ;
Le soufre est l'atome central car c'est le plus petit élément de la molécule, car tous les éléments doivent faire le même nombre de liaisons (deux);
Une double liaison entre le soufre et l'un des oxygènes. C'est parce que les deux ont besoin de deux connexions ;
Une liaison covalente coordonnée ou dative, car le soufre était stable après avoir fait l'appariement avec l'autre oxygène, mais il y a toujours un atome d'oxygène ayant besoin de deux électrons ;
Quatre électrons non-liants dans l'oxygène. C'est parce que l'oxygène a six électrons dans la couche de valence et n'en utilise que deux dans les liaisons.
Ainsi, comme dans la molécule de dioxyde de soufre, il y a trois atomes et quatre nuages électroniques (deux liaisons simples et deux paires d'électrons non liés) dans l'atome central, le la géométrie est angulaire.
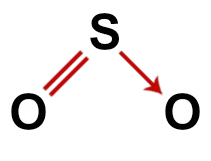
Formule structurelle correcte du dioxyde de soufre
Noter: Chaque fois que la molécule a ces motifs, l'angle formé entre les atomes est d'environ 120O.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm
