Une transformation isobare se produit lorsque le gaz est à une pression constante. Par exemple, si elle est effectuée dans un environnement ouvert, la transformation sera isobare car la pression sera la pression atmosphérique qui ne changera pas.
Dans ce cas, la température et le volume varient. Deux scientifiques de premier plan ont étudié comment cette variation dans les transformations isobares se produit. Le premier à rapporter le volume et la température des gaz fut Jacques Charles (1746-1823), en 1787, puis, en 1802, Joseph Gay-Lussac (1778-1850) quantifia cette relation.
Ainsi, une loi a émergé qui explique les transformations isobares des gaz, qui est devenue connue sous le nom de loi de Charles/Gay-Lussac. Il est indiqué comme suit :
"Dans un système à pression constante, le volume d'une masse fixe d'un gaz est directement proportionnel à la température."

Cela signifie que si nous doublons la température, le volume occupé par le gaz doublera également. Par contre, si on diminue la température, le volume de gaz diminuera également dans la même proportion.
Cela peut être vu dans une expérience très simple. Si nous plaçons un ballon dans le goulot d'une bouteille, une masse d'air fixe sera piégée. Si nous plongeons cette bouteille dans un bol d'eau glacée, le ballon se dégonflera. Maintenant, si nous le mettons dans un bol d'eau chaude, le ballon se remplira.
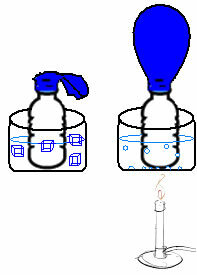
En effet, à mesure que la température augmente, l'énergie cinétique des molécules de gaz augmente et la vitesse à laquelle elles se déplacent augmente également. Ainsi, le gaz se dilate, augmentant le volume qu'il occupe, et le ballon se gonfle. L'inverse se produit lorsque nous abaissons la température, en la mettant dans de l'eau froide.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Cette relation entre la température et le volume dans les transformations isobares est donnée par la relation suivante :
V = k
T
« k » est une constante, comme le montre le graphique suivant :
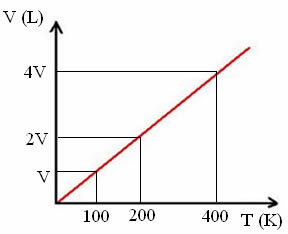
Notez que le rapport V/T donne toujours une constante :
_V_ =_2V_ = _4V_
100 200 400
Ainsi, nous pouvons établir la relation suivante pour les transformations isobares :
Vinitiale = VFinal
Tinitiale TFinal
Cela signifie que lorsqu'il y a un changement dans la température du gaz à pression constante, nous pouvons trouver son volume en utilisant cette expression mathématique. L'inverse est également vrai, connaissant le volume du gaz, on découvre à quelle température il se trouve. Voir un exemple :
"Une masse gazeuse occupe un volume de 800 cm3 à -23°C, à une pression donnée. Quelle est la température enregistrée lorsque la masse gazeuse, à la même pression, occupe un volume de 1,6 L ?
Résolution:
Données:
Vinitiale = 800cm3
Tinitiale = -23 ºC, en ajoutant à 273 on a 250 K (Kelvin)
VFinal = 1,6 L
TFinal = ?
* Nous devons d'abord laisser le volume sur le même appareil. On sait que 1 dm3 équivaut à 1 litre. comme un 1 dm3 est le même que 1000 cm3, il apparaît que 1 litre = 1 000 cm3:
1L 1000cm3
x 800cm3
x = 0,8 L
* Maintenant, nous remplaçons les valeurs de la formule et trouvons la valeur de température finale :
Vinitiale = VFinal
Tinitiale TFinal
0,8_ = 1,6
250 tonnesFinal
0,8 TFinal = 250. 1,6
TFinal = 400
0,8
TFinal = 500K
* En passant à l'échelle Celsius, nous avons :
T (K) = T (°C) + 273
500 = T (°C) + 273
T (°C) = 500 - 273
T (°C) = 227°C
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Transformation isobare »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. Consulté le 27 juin 2021.
Que sont les gaz, quelles sont les propriétés des gaz, composés moléculaires, compressibilité, volume fixe, énergie cinétique moyenne, température absolue d'un gaz, gaz parfait, gaz réels, gaz parfait, variables d'état du gaz, volume d'un gaz, saisons
Chimie

Lois de Gay-Lussac, Loi de Proust, Réaction chimique, Proportion constante, Masses de substances, Substance pure, Analyse qualitatif et quantitatif, loi des gaz parfaits, loi des proportions constantes, loi des proportions définies, loi volumétrique.