L'un des plus grands défis pour quiconque apprend la chimie s'appelle la distribution électronique. Ce que nous allons présenter dans ce contexte peut grandement faciliter vos études liées à la configuration électronique proposée par le scientifique Linus Pauling.
Le nombre maximal d'électrons qui tient dans chaque couche ou niveau d'énergie est indiqué dans le tableau :
Niveau d'énergie Couche Nombre maximum d'électrons
1er K 2
2e L 8
3e M18
4e N 32
5° O 32
6e P18
7e Q8
L'ordre croissant de l'énergie des sous-niveaux est l'ordre dans la séquence des diagonales. Le diagramme de Linus Pauling est illustré ci-dessous :
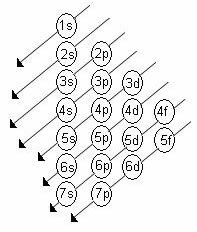
Règles de base:
1. Le numéro atomique (Z) de l'élément, à l'état neutre, indique le nombre d'électrons à distribuer. Ce nombre est représenté dans la partie inférieure gauche du symbole de l'élément.
2. A l'aide du diagramme de Pauling, commencez à répartir les électrons de haut en bas, en tenant compte de l'ordre croissant de l'énergie (orienté par le sens des flèches).
3. Remplissez les sous-niveaux avec le niveau maximum d'électrons. Si un sous-niveau donné ne contient que 6 électrons, ne dépassez pas ce montant.
4. Vérifiez le nombre d'électrons en les additionnant dans chaque sous-niveau.
Mettons-le en pratique?
Répartir les électrons de l'atome de fer (Z=26).
Si le numéro atomique est 26, cela signifie que dans l'atome de fer normal, il y a 26 électrons. En appliquant le diagramme de Pauling, nous aurons :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Par Líria Alves
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Règles de distribution électronique »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm. Consulté le 27 juin 2021.