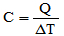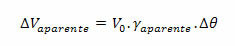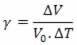La théorie quantique est également connue sous le nom de mécanique quantique ou physique quantique, et son principal domaine d'étude est le monde microscopique.
Les principes de quantification de l'énergie, proposés par Einstein et Planck, et les observations expérimentales du spectre atomique de éléments ont montré que les lois de Newton ne produisaient pas de résultats corrects lorsqu'elles étaient appliquées à de très petits systèmes tels que les atomes et molécules.
Pour expliquer le mouvement des électrons autour du noyau, une nouvelle théorie a été créée - par Planck, Bohr, Einstein et Schrödinger - celle de la mécanique quantique.
Malgré son énorme succès, la théorie de Bohr présentait plusieurs lacunes. Le spectre d'atomes plus complexes n'a pas pu être expliqué, soulevant des questions telles que: pourquoi certaines stries dans le spectre sont-elles plus intenses que d'autres? Et surtout, comment les atomes interagissent-ils entre eux pour former des systèmes stables ?
En 1911, Rutherford proposa un modèle atomique dans lequel des électrons (e-) encerclaient le noyau chargé positivement, d'une manière analogue au mouvement des planètes autour du Soleil. Bien que simple et cohérent, ce modèle avait une erreur incorrigible, puisque chaque particule qui décrit un mouvement circulaire a une accélération. Ainsi, comme Maxwell l'avait expliqué à travers ses équations, parce que l'électron avait une accélération, il devrait émettre de la lumière, perdant progressivement de l'énergie jusqu'à ce qu'il frappe le noyau.
Bohr, s'appuyant sur les concepts de quantification, stipulait que l'énergie des électrons dans leurs orbites autour du noyau était également quantifiée. C'est-à-dire que dans un atome comme l'hydrogène, il existe plusieurs orbites stables possibles pour l'électron, chacune avec une énergie différente. Il a donc pu corriger le modèle de Rutherford.
Mais ce n'est qu'avec les travaux d'Erwin Schrödinger et de Werner Heisenberg, en 1925, que la théorie quantique s'est imposée. Schrödinger a postulé une équation qui permet de calculer les niveaux d'énergie et la probabilité de trouver une particule dans une certaine région.
Par les lois de Newton, nous pouvons décrire le mouvement des électrons (position et vitesse) à partir des forces agissant sur eux. La théorie quantique, à son tour, calcule la probabilité de trouver l'électron (ou une autre particule) dans une région de l'espace, en utilisant l'équation de Schrödinger.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Par Domitiano Marques
Diplômé en Physique
Équipe scolaire du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
SILVA, Domitiano Correa Marques da. "Théorie des quanta"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/fisica/teoria-quantica.htm. Consulté le 27 juin 2021.