Réactions de sulfonation dans les alcanes elles sont réactions de substitution organique, réalisée dans le but de produire acides sulfoniques (composés organiques qui ont le groupe SO3H attaché à un atome de carbone ou à une chaîne carbonée) et de l'eau (H2O).
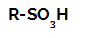
Formule développée d'un acide sulfonique
Pour effectuer une réaction de sulfonation sur alcanes, il faut mélanger un alcane (composé formé d'une chaîne carbonée saturée uniquement d'atomes de carbone et d'hydrogène) et le acide sulfurique (H2SEUL4) concentré, soumis à un chauffage (∆).
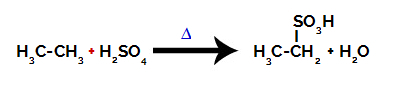
Équation chimique représentant la sulfonation d'un alcane à deux carbones
Principes de la réaction de sulfonation dans les alcanes
Tel que réaction de sulfonation d'alcane c'est une réaction de substitution, nous avons en elle un échange entre des composants plus petits électronégativité des réactifs, c'est-à-dire entre l'alcane et l'acide sulfurique. L'alcane a de l'hydrogène et de l'acide sulfurique, le groupe sulfonique.
Ci-dessous, nous avons le pas à pas du mécanisme d'un
réaction de sulfonation dans les alcanes. A titre d'exemple, nous utiliserons l'alcane le plus simple, le méthane (CH4):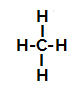
Formule développée du méthane
1ère étape : Perturbation de la liaison entre l'hydroxyle (OH) et le soufre (S) dans l'acide sulfurique.
Chaque groupe hydroxyle présent dans l'acide sulfurique se caractérise par être plus électronégatif. Avec le chauffage pendant la réaction, la tendance est que la liaison entre le groupe hydroxyle et le soufre est rompue :
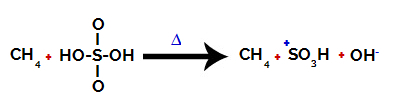
Perturbation de la liaison entre le soufre et l'hydroxyle
Cependant, la rupture de la liaison de tous les hydroxyles ne se produit pas en raison du réarrangement électronique dans la structure. Un anion hydroxyde (OH) est alors obtenu.-) et un cation sulfonique.
2ème étape : Attaque du groupe hydroxyle sur la molécule d'alcane.
Ensuite, le groupe hydroxy (OH-) effectue une attaque sur l'alcane, provoquant la rupture de la liaison entre le carbone et l'hydrogène (qui est plus fragile en raison de la différence d'électronégativité entre eux).
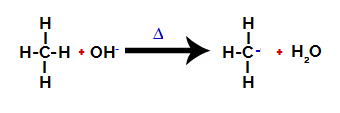
Rupture de la liaison entre le carbone et l'hydrogène dans l'alcane
Noter: La rupture de la liaison entre le carbone et l'hydrogène se produira toujours le plus souvent sur du carbone de densité ou de charge électronique inférieure. Moins le carbone contient d'hydrogènes, ou plus il y a de groupes qui lui sont attachés, plus sa densité électronique est faible. Donc nous avons:
Carbone tertiaire < Carbone secondaire < Carbone primaire
Une fois la liaison rompue, l'alcane devient un carbone déficient en électrons (carbocation). Le groupe hydroxyde (OH)-) interagit avec l'hydrogène libéré et forme une molécule d'eau.
3ème étape : Attaque du radical formé sur le groupe sulfonique.
Enfin, le groupe sulfonique est attaqué par le reste de l'alcane, formant un acide sulfonique.
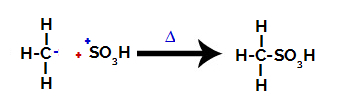
Structures qui interagissent et forment de l'acide sulfonique
Exemples d'équations représentant des réactions de sulfonation dans les alcanes
1er exemple : Sulfonation du propane.
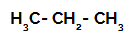
Formule développée du propane
Le propane a deux carbones primaires et un carbone secondaire, qui ont des charges différentes car ils sont liés à différentes quantités d'hydrogène. Comme le carbone est plus électronégatif que l'hydrogène, ces carbones ont des densités d'électrons différentes.
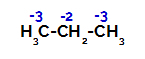
Répartition des charges sur chaque atome de carbone du propane
Sur les carbones primaires, la charge est de -3 (car il est lié à trois hydrogènes), et sur le carbone secondaire, la charge est de -2 (car il est lié à deux hydrogènes). Ainsi, il y aura rupture de la liaison entre le carbone et l'hydrogène, tantôt sur le carbone 1 (d'une molécule), tantôt sur le carbone 2 (d'une autre molécule).
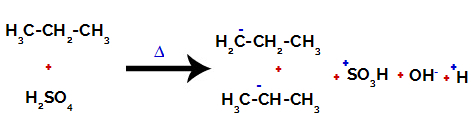
Rupture de la liaison entre le carbone et l'hydrogène sur différents carbones
Après la rupture des liaisons, aussi bien en acide sulfurique qu'en alcane, il y a formation de produits avec le remplacement de l'hydrogène sur le carbone 1 par un groupe sulfonique, et la même chose se produit sur le carbone 2.
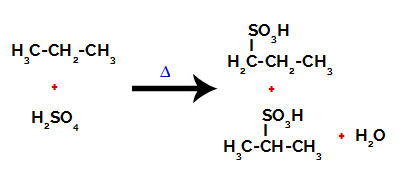
Produits formés à partir de la sulfonation du propane
2e exemple : Sulfonation du 2-méthyl-butane.

Formule développée du 2-méthyl-butane
Le 2-méthylbutane a trois carbones primaires, un carbone secondaire et un carbone tertiaire, qui ont des charges différentes et, par conséquent, des densités électroniques différentes, comme on peut le voir dans la structure suivante :
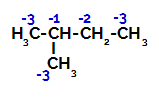
Répartition des charges électroniques dans le 2-méthyl-butane
Par conséquent, il existe dans le 2-méthyl-butane plusieurs possibilités de rompre la liaison entre le carbone et l'hydrogène, qui peut se produire sur le carbone 1 (d'une molécule), le carbone 2 (d'une autre molécule), le carbone 3 ou le carbone 4. Cependant, il est à noter que la perturbation au carbone numéro 2 est plus fréquente.
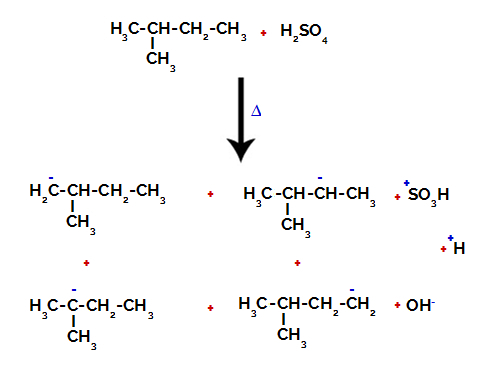
Rupture de la liaison entre le carbone et l'hydrogène sur différents carbones
Après les ruptures entre les liaisons, tant en acide sulfurique qu'en alcane, la formation de produits avec le remplacement de l'hydrogène sur le carbone 1 par un groupe sulfonique, et la même chose se produit sur le carbone 2.

Produits formés à partir de la sulfonation du 2-méthyl-butane
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm


