Les liaisons covalentes peuvent se produire sous forme moléculaire ou dative et coordonnée.
Liaison covalente moléculaire
Dans cette liaison, les atomes sont liés du fait du partage de leurs électrons, puis les paires électroniques indiquées par le cercle apparaissent :
Liaison covalente moléculaire de deux atomes de chlore (Cl).
Chaque paire électronique formée appartient simultanément aux deux atomes. Les molécules sont des structures électriquement neutres car il n'y a ni gain ni perte d'électrons, seulement un partage.
L'eau est un composé moléculaire constitué de deux atomes d'hydrogène (H2) et un oxygène (O).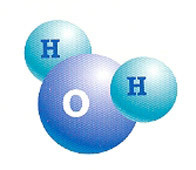
liaison covalente dative et coordonnée
Cette liaison obéit à la théorie de l'octet: les atomes s'unissent pour tenter d'acquérir huit électrons dans la couche de valence, c'est-à-dire la configuration électronique des gaz rares.
Ainsi, un atome qui a déjà atteint la stabilité électronique rejoint un autre qui a besoin d'électrons pour compléter la couche de valence. Un exemple de cette liaison est lorsqu'un atome de soufre se lie à deux atomes d'oxygène pour former du dioxyde de soufre (SO
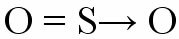
L'atome de soufre (S) acquiert son octet avec la formation d'une double liaison avec l'oxygène situé à gauche (liaison coordonnée), mais en même temps l'oxygène positionné à droite a besoin d'électrons pour compléter son octuor. Apparaît alors la liaison covalente dative représentée par un petit vecteur (flèche). La flèche indique que le “s” fait don d'une paire d'électrons au “O”.
Regardons le partage des électrons dans la formation du composé trioxyde de soufre (SO3).
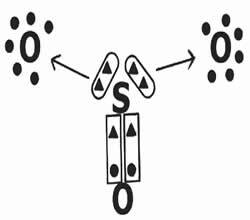
Notez que l'élément central (soufre) établit une double liaison (coordonnée) avec l'un des oxygènes, réalisant une stabilité électronique (huit électrons dans la couche de valence). En revanche, il fait don de deux paires d'électrons aux oxygènes (liaison dative indiquée par la flèche →) pour tenter de compléter l'octet.
Par Líria Alves
Diplômé en Chimie
Voir plus!
Connexion en métal
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/ligacao-covalente.htm

