Si nous utilisons un voltmètre dans une batterie, nous pourrons identifier la différence de potentiel (U ou ddp) ou de force électromotrice (emf ou E) entre les deux électrodes. Cependant, il n'est pas possible d'identifier de cette manière les potentiels de réduction ou d'oxydation de chaque électrode.
Les scientifiques avaient besoin de connaître ces valeurs pour étudier les processus d'oxydo-réduction, ils ont donc établi un état de référence. Cela signifie qu'il a été convenu de mesurer le potentiel de chaque électrode par rapport à une autre électrode dans les conditions standard suivantes :
• La température doit être à 25°C ;
• Pression à 1,0 atm ;
• La concentration de la solution dans laquelle le métal est immergé doit être de 1,0 mol/L.
Ainsi, l'électrode choisie était la électrode à hydrogène, qui est représenté ci-dessous :
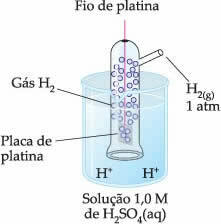
Cette électrode est composée d'un fil de platine relié à une plaque de platine, qui ne participe pas à la réaction, à l'intérieur d'un tube contenant de l'hydrogène gazeux et immergé dans une solution acide. Dans l'exemple, la solution était de l'acide sulfurique.
| Par convention, l'électrode standard à hydrogène a reçu la valeur zéro, tant pis pour le E0rouge comme pour le E0oxy. |
Ainsi, pour trouver la valeur potentielle de toute autre électrode, nous construisons simplement un empilement de l'électrode que nous voulons avec l'électrode à hydrogène standard et mesurons le ddp avec un voltmètre. La valeur affichée sur le voltmètre sera le potentiel de l'électrode recherchée, puisque celui de l'hydrogène est égal à zéro.
Par exemple, nous interconnectons une électrode de zinc avec l'électrode d'hydrogène pour connaître son potentiel de réduction :
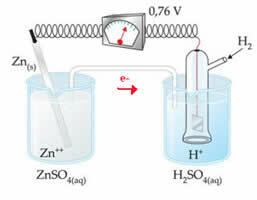
Selon le schéma ci-dessus, le voltmètre a identifié la différence de potentiel comme étant égale à +0,76 9(?E0 = +0,76). On note aussi que l'électrode de zinc s'est oxydée, c'est donc l'anode; et l'électrode à hydrogène réduite, étant la cathode.
Donc nous avons:
?E0 = E0rouge (cathode) - E0 rouge (anode)
0,76 = 0,00 - E0 rouge (Zn)
E0 rouge (Zn) = 0,00-0,76
E0 rouge (Zn) = -0,76
La valeur négative signifie que le courant électronique passe de l'électrode de zinc (anode) à l'électrode d'hydrogène, se comportant ainsi comme une cathode. S'il était positif, ce serait l'inverse, et l'électrode à hydrogène se comporterait comme une anode. Cela peut être vu lorsque nous interconnectons une électrode de cuivre avec l'électrode à hydrogène standard :
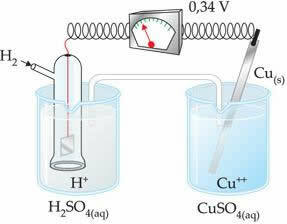
?E0 = E0rouge (cathode) - E0 rouge (anode)
-0,34 = 0,00 - E0 rouge (Zn)
E0 rouge (Zn) = 0,00+0,34
E0 rouge (Zn) = +0.34
Ainsi, il est possible de définir les potentiels de réduction et d'oxydation pour les espèces chimiques les plus variées. Cependant, l'Union internationale de chimie pure et appliquée (IUPAC) recommande l'utilisation de potentiels de réduction uniquement. Et, quel que soit le métal utilisé, dans la représentation de la batterie, l'électrode à hydrogène vient toujours en premier, par exemple :
Pt – H2 (g) 1atm / H3O1+ (aq) 1 mol/L // Cu2+ (aq) 1 mol/L / Cu
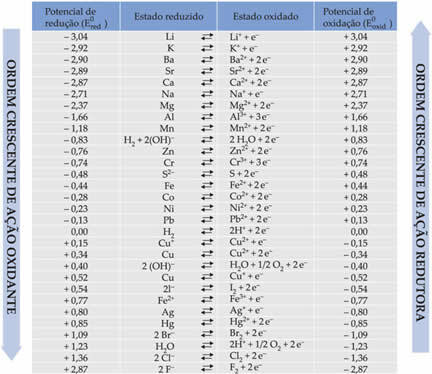
Le tableau ci-dessous répertorie les potentiels obtenus grâce à cette méthode d'utilisation de l'électrode à hydrogène standard, ainsi que leurs semi-réactions respectives :
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm
