Aussi bien que cyclanes, alcènes, alcynes, entre autres, le alcadiènes subissent aussi les appels réactions d'addition. Dans le texte sur réactions dans les diènes, vous constaterez que les réactions d'addition dépendent du type de diène sur lequel on travaille. Les diènes peuvent être classés en gros en :
condensé ou accumulé (pas de lien simple entre les deux doubles) ;
Exemple: H2C = CH-CH3
conjugué ou alterné (seulement une liaison simple entre les deux doubles) ;
Exemple: H2C = CH—CH = CH2
isolé (au moins deux liaisons simples entre les deux doubles).
Exemple: H2C = CH-CH2—CH2—CH = CH2
La réaction de Diels-Aulne a été développé en 1928 par deux chimistes allemands, Otto Paul Hermann Diels et Kurt Alder. C'est une réaction très importante en chimie organique car elle permet :
identifier les hydrocarbures diéniques;
obtenir des hydrocarbures cycliques saturés (de préférence les cyclohexanes).
Cette réaction organique ne se produit que dans alcadiènes ou diènes conjugués ou alternés et s'appelle
addition 1.4. Le composé dans lequel nous pouvons observer l'addition 1,4 de manière plus simple est le but-1,3-diène, illustré ci-dessous :H2C = CH—CH = CH2
REMARQUE: Dans ce composé, on a l'occurrence de phénomène de résonance, dans laquelle les électrons des deux liaisons pi se déplacent à travers la chaîne. Une paire de électrons pi commence à occuper la région centrale de la chaîne (entre les carbones 2 et 3), tandis que les électrons de l'autre liaison pi sont déplacés vers l'un des carbones terminaux. Ainsi, nous avons des sites de liaison sur les carbones 1 et 4 et un double entre les carbones 2 et 3.

Résonance dans la structure but-2,3-diène
À Réaction de Diels-Aulne, l'un des réactifs est un diène conjugué, tandis que l'autre est un composé organique qui peut présenter un appel double entre les atomes de carbone. Ci-dessous un exemple de Réaction de Diels-Aulne entre le but-2,3-diène et le propène :
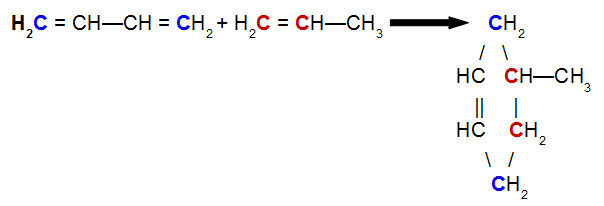
Équation d'une réaction de Diels-Alder du but-2,3-diène avec le propène
En analysant l'équation ci-dessus, nous pouvons voir que les carbones 1 et 4 (tous deux en bleu) de la liaison but-2,3-diène respectivement aux carbones 1 et 2 (tous deux rouges) du propène, donnant naissance à un cyclène ramifié, le 4-méthyl-cyclohexène. Cela est dû à la résonance dans la molécule de but-2,3-diène, qui déplace une liaison pi entre les carbones 2 et 3, et à la rupture de la liaison pi entre les carbones 1 et 2 du propène.
OBS.² : Il est important de souligner que, quel que soit le composé qui réagit avec l'alcadiène conjugué, il y aura une rupture de la liaison pi uniquement entre les atomes de carbone de la chaîne. Si la structure a des liaisons pi entre des atomes autres que le carbone, elles ne seront pas rompues. Vous trouverez ci-dessous un exemple de structure pouvant réagir avec un alcadiène dans un Réaction de Diels-Aulne, ce qui entraîne la rupture de la liaison pi entre les carbones (en bleu) de la double liaison.
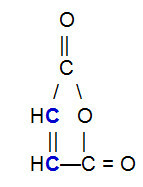
Formule développée de l'anhydride maléique
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/reacoes-diels-alder.htm

