Comme il existe des milliers de composés organiques, le phénomène d'isomérie peut prendre plusieurs formes. Par conséquent, l'isomérie peut être essentiellement classée en deux types: isomérie plate ou constitutionnelle et isomérie spatiale ou stéréoisomérie. Chaque type mentionné peut être subdivisé, comme le montre le schéma suivant :
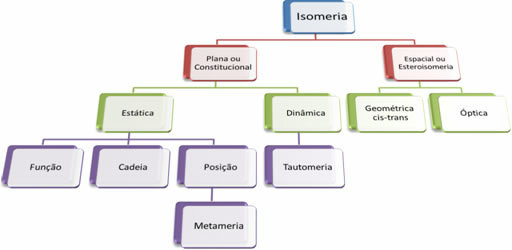
Voir chaque cas :
1. Isomérie plate ou constitutionnelle : Les isomères de ce type ont la même formule moléculaire et se distinguent par des formules structurelles plates. Il existe cinq cas d'isomérie plane: fonction, chaîne, position, métamérisme et tautomérie.
1.1.Isomérie fonctionnelle ou fonctionnelle: La différence entre les isomères réside dans le groupe fonctionnel.
Exemple: formule moléculaire C3H6O
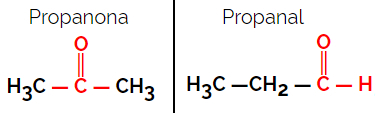
Notez que la propanone appartient au groupe cétone et que le propanal appartient au groupe aldéhyde.
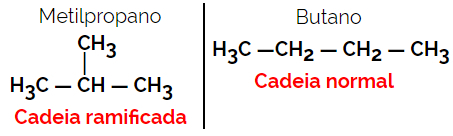
1.2. Isomères en chaîne ou squelettiques : La différence entre les isomères réside dans le type de chaîne. Par exemple, un isomère est à chaîne ouverte et l'autre à chaîne fermée, ou l'un est à chaîne normale et l'autre à chaîne ramifiée, ou l'un est une chaîne homogène et l'autre est une chaîne hétérogène.
Exemple: formule moléculaire C4H10
1.3.Isomérie positionnelle ou positionnelle : La différence réside dans la position d'une insaturation, d'un groupe fonctionnel, d'un hétéroatome ou d'un substituant.
Exemple: formule moléculaire C4H6

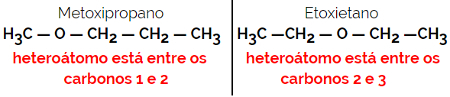
1.4.Isomérie de compensation ou métamérie: C'est un type spécial d'isomérie de position, où la différence est la position de l'hétéroatome.
Exemple: formule moléculaire C4H10O
1.5.Isomérie dynamique ou tautomérie : C'est un type particulier d'isomérie de fonction, dans laquelle les isomères coexistent en équilibre dynamique en solution. Les deux principaux types de tautomérie se situent entre une cétone et un énol (balance cétoénolique) et entre un aldéhyde et un énol (balance aldoénolique).
Exemple: formule moléculaire C3H6O
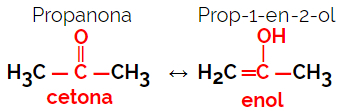
2. Isomérie spatiale ou stéréosomérie : Dans ce cas, la différence entre les isomères ne peut être visualisée que par l'orientation de leurs atomes dans l'espace. Il existe deux types de stéréoisomérie: l'isomérie géométrique et l'isomérie optique.
2.1.Isomères géométriques ou cis-trans: La différence est que l'isomère nommé cis il a les mêmes ligands carbonés dans une double liaison ou dans des composés cycliques du même côté du plan. Les ligands isomères trans sont sur des côtés opposés.
Exemple: formule moléculaire C2H2Cl2

Ces composés sont appelés stéréoisomères.
2.2.Isomère optique: Se produit lorsque les isomères sont capables de dévier un faisceau de lumière polarisée. S'il courbe le faisceau lumineux polarisé vers la gauche, il s'agit d'un isomère lévogyre, mais s'il se courbe vers la droite, il est appelé isomère droitier.
Exemple:
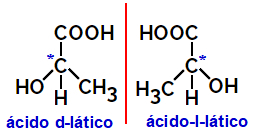
Les molécules asymétriques comme celles montrées ci-dessus, qui sont des images miroir les unes des autres et qui ne sont pas superposables, sont appelées énantiomères.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

