Le volume atomique n'est pas le volume qu'un atome occupe, mais fait référence à la volume occupé par une quantité fixe d'un nombre donné d'atomes d'un élément chimique.
Dans le texte Élément chimique, il a été montré qu'un élément correspond à un ensemble d'atomes qui ont le même numéro atomique, c'est-à-dire la même quantité de protons dans le noyau. La quantité établie pour calculer le volume atomique est la valeur de constante d'Avogadro, qui est égal à 6,02. 1023 atomes, ce qui correspond à 1 mole de l'élément.
On peut donc dire que le volume atomique est le volume que 1 mole d'atomes (ou 6,02). 1023 atomes) d'un élément occupe.
Cette quantité peut être calculée si nous connaissons la densité de l'élément à l'état solide et la masse de 1 mole d'atomes de cet élément. Par exemple, considérons que la densité du sodium (Na) est égale à 0,97 g/cm3 et que 6.02. 1023 les atomes de sodium ont une masse égale à 23,0 g. On peut alors, à partir de la formule de la densité, arriver au volume atomique du sodium. Regarde comment:
densité = Pâtes
le volume
volume atomique = masse de 6,02. 1023 atomes d'élément
densité d'éléments à l'état solide
Volume atomique de sodium = 23,0 g
0,97 g/cm3
Volume atomique de sodium = 23,71 cm3
La valeur du volume atomique implique non seulement la taille des atomes, mais aussi la distance entre eux. Par conséquent, puisqu'il s'agit également d'espaces vides, nous ne pouvons pas prendre la valeur du volume atomique et diviser par le nombre d'atomes (6.02. 1023) pour trouver le volume occupé par chaque atome.
Il est important d'étudier le volume atomique car c'est une propriété périodique, c'est-à-dire qu'il varie en fonction du numéro atomique de l'élément. Regardez l'image ci-dessous. Le volume atomique des éléments grandit de haut en bas, ce qui signifie que lorsque nous analysons les éléments appartenant à la même famille du tableau périodique, à mesure que le numéro atomique augmente, le volume atomique augmente également. En effet, en ce sens, les périodes augmentent, ce qui signifie que les couches électroniques des atomes augmentent et, par conséquent, le volume qu'elles occupent augmente également. C'est le même sentiment de croissance que rayon atomique.
Par contre, horizontalement, on voit que le volume atomique augmente du centre vers les bords. Lorsque nous partons de la gauche et allons à droite au milieu du tableau périodique, le volume atomique diminue car la période est le même, c'est-à-dire que les éléments d'une même ligne ont la même quantité de couches électroniques, mais le numéro atomique sera en augmentant. Cela signifie que la quantité d'électrons augmente dans cette direction, ce qui entraîne une plus grande force de attraction des électrons vers le noyau de l'atome, diminuant son rayon atomique et, par conséquent, le volume atomique. Mais du centre vers la droite, cela ne continue pas à se produire, car, dans le cas d'éléments situés dans cette région, surtout dans le cas des non-métaux, l'espacement entre leurs atomes est relativement grand, ce qui affecte le volume atomique, l'augmenter.
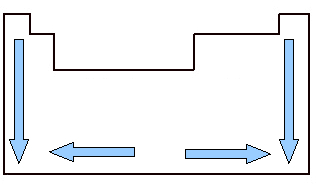
Variation du volume atomique dans le tableau périodique selon les familles et les périodes
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/volume-atomico.htm
