sels inorganiques ils sont formés par l'association ionique d'au moins un cation (formé par tout métal ou par l'ammonium) et un anion (simple ou composé).
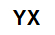
Formule moléculaire générale d'un sel
Lorsqu'ils sont ajoutés à l'eau, les sels se dissocient, libérant au moins un cation autre que l'hydronium (H+) et un anion autre que l'hydroxyde (OH-).
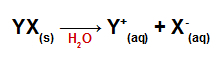
Équation de dissociation pour tout sel
Classification des sels
Les sels, en général, peuvent avoir les classifications suivantes :
sel simple: sel formé d'un seul cation et d'un anion. Exemples: NaCl, CaSO4, KCN, NH4CO3 etc.
Sel hydrogéné : il a deux cations (dont l'un doit être l'hydronium) et un anion. Exemples: NaHCO3, CaHBO3 etc.
Sel d'hydroxyle : il a un cation et deux anions (dont l'un doit être l'hydroxyde). Exemples: MgOHCl, Al(OH)2ClO3 etc.
Sel hydraté : présente des molécules d'eau associées à sa structure cristalline. Exemples: CaCl2.2H2O, CuSO4.6H2Les etc.
Sel double : il a deux cations (tous différents de l'hydronium) et un anion ou un cation et deux anions (tous différents de l'hydroxyde). Exemples: Tapez4CN, AgFeBO3 etc.
Alun: est le sel formé par deux sulfates avec des cations NOx égaux à +1 et +3, plus 24 molécules d'eau. Exemples: Ag2SEUL4.Al2(SEUL4)3.24H2sur un2SEUL4.Sb2(SEUL4)3.24H2O
Règle de nommage du sel
Nom de l'anion + nom de + nom du cation
→ K3POUSSIÈRE4
Le sel a l'anion phosphate (PO4-3) et le cation potassium (K+1), d'où son nom est phosphate de potassium.
→ Cas3
Le sel a l'anion sulfite (SO3-2) et le cation calcium (Ca+2), d'où son nom est sulfite de calcium.
REMARQUE: Si le cation n'est pas de l'argent, du zinc ou un élément appartenant aux familles IA, IIA et IIIA, il faut indiquer son NOX avec un chiffre romain devant le nom du cation.
→ Cu2SEUL4
Le sel a l'anion sulfate (SO4-2) et le cation calcium (Cu+1), d'où son nom est sulfate de cuivre I.
Sel hydrogéné : Pour ce sel, avant le nom de l'anion, il faut écrire le préfixe faisant référence à la quantité d'hydrogène dans la formule. Ce préfixe doit être séparé du mot hydrogène par un trait d'union.
→ NaHCO3
Le sel a un hydrogène, un anion carbonate et un cation sodium, son nom est donc le monohydrogénocarbonate de sodium.
Sel d'hydroxyle : Pour ce sel, avant le nom de l'anion, il faut écrire le préfixe faisant référence à la quantité d'hydroxyles dans la formule. Ce préfixe doit être séparé du mot hydroxy par un trait d'union.
→ Al(OH)2ClO3
Le sel a deux hydroxyles, l'anion chlorate et le cation aluminium, son nom est donc dihydroxychlorate d'aluminium.
Sel hydraté : Pour ce sel, après le nom du cation, il faut écrire le préfixe faisant référence à la quantité de molécules d'eau dans la formule. Ce préfixe doit être séparé du mot hydraté par un trait d'union.
→ CaCl2.2H2O
Le sel a deux molécules d'eau, l'anion chlorure et le cation calcium, son nom est donc chlorure de calcium dihydraté.
Sel double avec deux cations : Pour ce sel, il faut écrire le double mot entre parenthèses après le nom de l'anion puis le nom du cation le plus électropositif et l'autre cation.
→ AgFeBO3
Ce sel contient de l'argent (plus de cations électropositifs) et du fer II, en plus de l'anion borate. Son nom est borate (double) d'argent et de fer II.
-
Sel double avec deux anions:
Nom de l'anion le plus électronégatif + tiret + nom de l'anion le moins électronégatif + dé + nom du cation
→ Taper4CN
Ce sel contient le cation titane IV, en plus du phosphate (anion plus électronégatif) et de l'anion cyanure. Son nom est le phosphate de cyanure de titane IV.
Sel d'alun : Pour ce sel, on ignore la règle générale. Il suffit d'écrire le terme alun suivi du nom du cation de charge +3 et du nom du cation de charge +1, respectivement, séparés par la conjonction e.
→ Dans2SEUL4.Sb2(SEUL4)3.24H2O
Le sel d'alun a le cation d'antimoine +3 et le cation de sodium +1, son nom est donc l'alun d'antimoine III et le sodium.
Caractéristiques physiques des sels
Ils sont solides à température ambiante ;
Ils ont des points de fusion et d'ébullition élevés;
Ils sont formés de liaisons ioniques ;
Ils conduisent un courant électrique à l'état liquide (après fusion) ou lorsqu'ils sont dissous dans l'eau ;
De manière générale, ils sont solubles dans l'eau, mais il existe des sels qui sont considérés comme pratiquement insolubles.
Propriétés chimiques des sels
Les sels sont des composés qui ont la capacité de réagir chimiquement (à condition qu'ils n'aient pas le même cation ou le même anion qu'une autre substance) avec plusieurs groupes de substances, à savoir :
Dans une double réaction d'échange avec un acide: ils forment un nouveau sel et un nouvel acide.
Dans une double réaction d'échange avec une base: ils forment un nouveau sel et une nouvelle base.
Dans un double réaction d'échange avec un autre sel : former deux nouveaux sels.
Certains sels ont la capacité de souffrir décomposition lorsqu'il est soumis à la chaleur, formant deux ou plusieurs nouvelles substances. Si nous chauffons le bicarbonate de sodium (NaHCO3), par exemple, il se décomposera en formant du carbonate de sodium (Na2CO3), eau (H2O) et le dioxyde de carbone (CO2).
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm


