O rayon atomique (r) est généralement défini comme la moitié de la distance entre deux noyaux d'atomes voisins, comme le représente la figure ci-dessous :

rayon atomique
Le rayon atomique diffère d'un atome à l'autre selon sa famille et sa période sur le tableau périodique. En ce qui concerne les éléments appartenant à un même famille, son rayon atomique augmente à mesure que le numéro atomique augmente., c'est-à-dire de haut en bas. Car, en ce sens, cela signifie que d'un atome à l'autre un niveau d'énergie ou couche électronique a augmenté, donc son rayon augmente proportionnellement.
En ce qui concerne l'élément dans la même période, c'est-à-dire horizontalement, le rayon augmente de droite à gauche, ou à mesure que le numéro atomique diminue. C'est parce qu'ils ont tous le même nombre de couches, ce qui fait la différence est la quantité de électrons dans ces couches, et plus il y a d'électrons, plus l'attraction vers le noyau est grande, diminuant ainsi le rayon du atome.

Direction de croissance du rayon atomique selon la famille et la période du tableau périodique
Cependant, le rayon atomique peut varier en fonction de la connexion qui est établie. Voyons comment cela se passe :
*Liaison ionique: Si l'atome forme un cation, le rayon atomique diminuera, puisque perdant un ou plusieurs électrons, le noyau attirera les électrons plus intensément. Maintenant si former un anion, c'est-à-dire gagner des électrons, le rayon de l'atome va augmenter, car la charge totale de l'électrosphère sera supérieure à la charge totale du noyau, diminuant son attraction. Plus vous gagnez ou perdez d'électrons, plus grande sera la variation de la taille du faisceau.
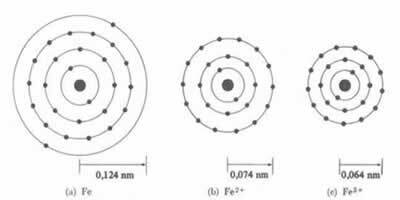
Le diamètre ou le rayon du cation est toujours plus petit que le diamètre ou le rayon de l'atome
Aussi, dans une série de ions isoélectroniques, qui ont la même quantité d'électrons et les mêmes niveaux d'énergie, l'ion avec le plus petit numéro atomique aura un plus grand rayon. Par exemple, les ions 13Al3+, 12mg2+, 11À1+, 9F-1, 8O2- et 7N-3, tous ont 10 électrons et 2 niveaux électroniques. Mais ce qui a le plus grand rayon est le 7N-3, car il a le plus petit numéro atomique (Z= 7).
*Une liaison covalente: Lorsque deux atomes forment une liaison covalente, si les deux atomes sont égaux, comme dans le cas de l'hydrogène gazeux (H2), on peut parler d'un rayon covalent (r), qui est la moitié de la longueur de la liaison (d), c'est-à-dire la moitié de la distance séparant les deux noyaux. Même si, si la liaison est faite par des atomes différents, comme dans le cas du chlorure d'hydrogène (HCl), la longueur ou la distance (d) sera la somme des rayons covalents (r1 + r2) des atomes impliqués dans la covalence.
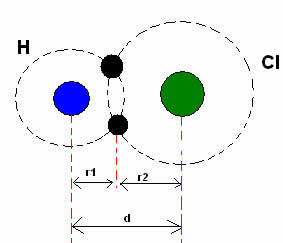
Somme des rayons atomiques dans une liaison covalente.
Bien sûr, nous devons nous rappeler que cette question est beaucoup plus compliquée, car le rayon covalent d'un atome peut varier lorsqu'il se lie avec d'autres atomes différents.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm
