UN deuxième loi de la thermodynamique dicte quelles conditions existent pour le chaleur être convertis en travail dans les moteurs thermiques et les réfrigérateurs. Il aborde également la définition de entropie comme un phénomène capable de mesurer la désorganisation des particules dans les systèmes physiques.
A lire aussi: Calorimétrie - la branche de la physique qui étudie l'échange de chaleur
Résumé sur la deuxième loi de la thermodynamique
La deuxième loi de la thermodynamique est représentée par les déclarations de Clausius et Kelvin-Planck.
L'énoncé de Clausius traite du flux de chaleur du corps le plus chaud vers le corps le plus froid.
La déclaration de Kelvin-Planck traite de l'incapacité des dispositifs thermiques à convertir toute leur chaleur en travail.
La deuxième loi de la thermodynamique s'applique aux moteurs thermiques et aux réfrigérateurs.
Le cycle de Carnot est le cycle de rendement maximal obtenu par les moteurs thermiques.
Le cycle de Carnot comporte quatre étapes, une détente isotherme réversible, une détente adiabatique réversible, une compression isotherme réversible et une compression adiabatique réversible.
Le théorème de Carnot fait référence au rendement de Machines Carnot.
Quelle est la seconde loi de la thermodynamique ?
La deuxième loi de la thermodynamique est une loi qui traite des contraintes qui se produisent dans les processus thermodynamiques. Elle a été énoncée par les physiciens Rudolf Clausius (1822-1888), Lord Kelvin (1824-1907) et Max Planck (1858-1947), comme nous le verrons ci-dessous :
Le physicien et mathématicien Rudolf Clausius a déclaré que le flux de chaleur par conduction se produit du corps à température plus élevée vers le corps à température plus basse. température plus basse, il n'est donc pas naturel que le processus inverse se produise, il est donc nécessaire d'effectuer des travaux sur cette système. Sur ce, il a déclaré :
Il est impossible de réaliser un processus dont le seul effet est de transférer la chaleur d'un corps plus froid vers un corps plus chaud.|1|
Le physicien mathématicien William Thomson, connu sous le nom de Lord Kelvin, ainsi que les contributions du physicien Max Planck, a déclaré l'impossibilité d'appareils thermiques ayant une efficacité de 100%, car il y aura toujours une perte de chaleur.
Applications de la seconde loi de la thermodynamique
La deuxième loi de la thermodynamique s'applique aux moteurs thermiques et aux réfrigérateurs.
Deuxième loi de la thermodynamique dans les machines thermique
Au Machines thermiques sont capables de convertir la chaleur en travail. Une source chaude fournit de la chaleur au moteur thermique qui la transforme en travail. Le reste de la chaleur qu'il envoie à la source froide, comme illustré dans l'image ci-dessous :
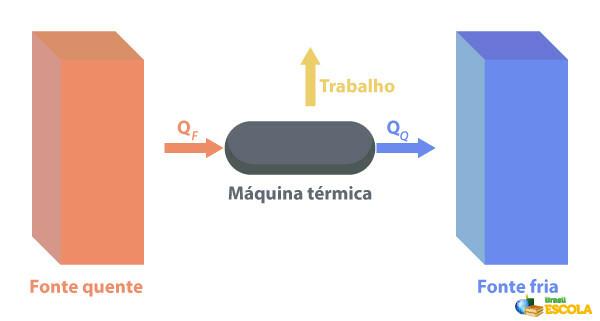
Quelques exemples de machines thermiques sont: les turbines à vapeur et à kérosène dans les avions à réaction, les moteurs à combustion, les réacteurs thermonucléaires.
Deuxième loi de la thermodynamique dans les réfrigérateurs
Les réfrigérateurs sont des machines qui Ils fonctionnent à l'inverse des moteurs thermiques., où ils évacuent la chaleur d'une région avec température une température plus basse et la fournir à une région avec une température plus élevée. Comme cela n'est pas naturel, il est nécessaire que la machine effectue un travail utilisant de l'énergie électrique, comme décrit dans l'image ci-dessous :
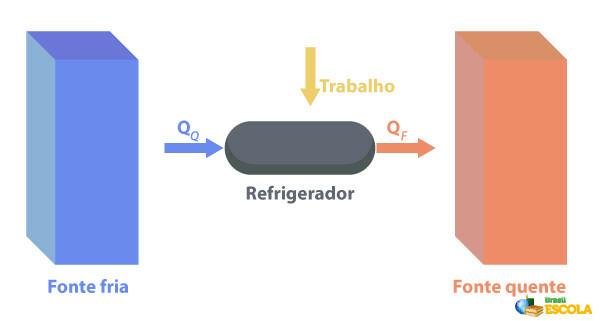
Quelques exemples de réfrigérateurs sont les réfrigérateurs et les climatiseurs.
Entropie et deuxième loi de la thermodynamique
UN deuxième loi de la thermodynamique propose l'existence de l'entropie, un quantité physique chargé de mesurer le degré de désorganisation des particules dans un système physique ou le degré d'irréversibilité de processus thermodynamiques impliqués dans les moteurs thermiques, étant un processus spontané, inévitable, irréversible et expansif. Avec cela, il est seulement possible d'observer et de contenir le degré de volatilité des processus. À mesure que l'entropie augmente, le degré de désordre dans le système augmente également.
UN La nomenclature entropique est d'origine grecque et signifie « transformation »., "changer", donc utilisé dans le Physique pour indiquer le hasard et le désordre. L'entropie peut être calculée à l'aide de la formule :
\(∆S=\frac{∆U}T\)
\(∆S\) est le changement d'entropie, mesuré en [J/K].
\(∆U\) est la variation d'énergie interne, mesurée en Joules [J].
T est la température, mesurée en Kelvin [K].
D'un point de vue statistique, l'entropie est calculée par la formule :
\(S=k\cdot ln\ Ω\)
S est l'entropie, mesurée en [J/K].
k est la constante de Boltzmann, elle vaut \(1,4\cdot 10^{-23}\ J/K\).
Ω est le nombre de micro-états possibles pour le système.
A lire aussi: Processus de propagation de la chaleur
Formules de la deuxième loi de la thermodynamique
Machines thermiques et réfrigérateurs
\(Q_Q=W+Q_F\)
\(Q_Q\) est la chaleur de la source chaude, mesurée en Joules [J].
W est le travail effectué par le moteur thermique, mesuré en Joules [J].
\(Q_F\) est la chaleur de la source froide, mesurée en Joules [J].
Il peut être représenté par :
\(W=Q_Q-Q_F\)
W est le travail effectué par le moteur thermique, mesuré en Joules [J].
\(Q_Q\) est la chaleur de la source chaude, mesurée en Joules [J].
\(Q_F\) est la chaleur de la source froide, mesurée en Joules [J].
Réfrigérateurs
\(η=\frac{Q_F}{Q_Q-Q_F}\)
\(η\) est l'efficacité du réfrigérateur.
\(Q_F\) est la chaleur de la source froide, mesurée en Joules [J].
\(Q_Q\) est la chaleur de la source chaude, mesurée en Joules [J].
Il peut être représenté comme :
\(η=\frac{Q_F}W\)
\(η\) est l'efficacité du réfrigérateur.
\(Q_F\) est la chaleur de la source froide, mesurée en Joules [J].
W est le travail effectué par le moteur thermique, mesuré en Joules [J].
Exemples d'application de formules
Exemple 1: Calculez le travail d'un moteur thermique pendant un cycle qui reçoit 500 J de chaleur de la source chaude et ne transfère que 400 J de chaleur à la source froide.
Pour calculer le travail d'un moteur thermique, nous utiliserons la formule :
\(W=Q_Q-Q_F\)
Remplacer les valeurs indiquées dans la déclaration :
\(W=500-400\)
\(W=100\ J\)
Le travail du moteur thermique était de 100 Joules.
Exemple 2 : Quelle est l'efficacité d'un réfrigérateur qui reçoit 150 J de chaleur de la source chaude et transfère 50 J de chaleur à la source froide ?
Pour calculer l'efficacité d'un réfrigérateur, nous utiliserons la formule :
\(η=\frac{Q_F}{Q_Q-Q_F}\)
En substituant les valeurs données dans l'instruction, on obtient :
\(η=\frac{50}{150-50}\)
\(η=\frac{50}{100}\)
\(η=0,5\)
Multiplier le rendement par 100 % :
\(η=0.5\cdot100%\)
\(η=50\%\)
Le réfrigérateur a une efficacité de 50 %.
Cycle de Carnot
Le cycle de Carnot a été développé par le scientifique Sadi Carnot (1796-1832), dans le but d'identifier le rendement maximum pouvant être atteint par un moteur thermique fonctionnant entre une source chaude et une source froide.
Sur la base de ses études, Carnot a identifié que, pour obtenir le maximum d'efficacité d'un moteur thermique, il est nécessaire pour que son processus soit réversible, il a donc développé le cycle de rendement maximal appelé cycle de Carnot, et le Le moteur thermique qui le traverse est appelé moteur thermique de Carnot.. Le cycle de Carnot étant réversible, il peut être inversé, c'est ainsi que les réfrigérateurs ont été développés.
Le cycle de Carnot, quelle que soit la substance utilisée, est composé de quatre processus décrits dans le graphique de pression par volume (p×V), comme on peut le voir sur l'image ci-dessous :
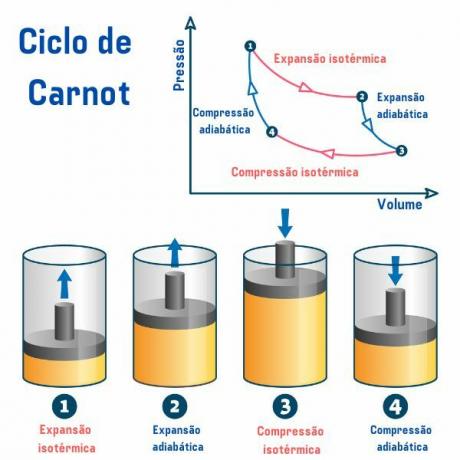
1er processus, du point 1 → 2: il y a une détente isotherme réversible (processus dans lequel la température reste constante), dans laquelle le gaz (ou le système) fonctionne et acquiert une quantité de chaleur de la source chaude.
2ème processus, du point 2 → 3: il y a une détente adiabatique (processus dans lequel il y a échange de chaleur avec le milieu extérieur) réversible, dans laquelle il n'y a pas d'échange de chaleur chaleur avec des sources thermiques, mais le gaz fonctionne et il y a une diminution de son énergie interne, provoquant une diminution de la température.
3ème processus, du point 3 → 4: une compression isotherme réversible se produit, dans laquelle le gaz reçoit du travail et cède une quantité de chaleur à la source froide.
4ème processus, du point 4 → 1: une compression adibatique réversible se produit, dans laquelle aucun échange de chaleur avec les sources thermiques n'a lieu et le gaz est chauffé jusqu'à ce qu'il atteigne la température de la source chaude, et ainsi être mis en contact avec elle, mettant fin à la cycle.
lois de la thermodynamique
Les lois de la thermodynamique sont quatre lois qui régissent toute l'étude de thermodynamique, étudier les relations entre le volume, la température et la pression et d'autres grandeurs physiques, telles que la chaleur et l'énergie.
Loi zéro de la thermodynamique : est la loi de bilan thermique, il étudie l'échange de chaleur entre des corps qui ont des températures différentes.
première loi de la thermodynamique: est la loi de conservation de l'énergie dans les systèmes thermodynamiques, elle étudie la transformation de la chaleur en travail et/ou en énergie interne.
Deuxième loi de la thermodynamique : c'est la loi qui traite des moteurs thermiques, des réfrigérateurs et de l'entropie.
Troisième loi de la thermodynamique : est la loi de zéro absolu, elle étudie les effets de cette température.
Lire aussi: Performances des moteurs thermiques
Exercices résolus sur la deuxième loi de la thermodynamique
question 1 Déterminer la température de la source chaude d'un moteur Carnot, sachant que la température de la source froide est de 450 K et que son rendement est de 80 %.
a) 2250K
b) 450K
c) 1500K
d) 900K
e) 3640K
Résolution:
Variante A. Nous allons calculer la température de la source chaude à partir de la formule de rendement d'un moteur Carnot :
\(η=1-\frac{T_F}{T_Q} \)
\(80 \%=1-\frac{450}{T_Q} \)
\(\frac{80}{100}=1-\frac{450}{T_Q} \)
\(0,8=1-\frac{450}{T_Q} \)
\(0,8-1=-\frac{450}{T_Q} \)
\(-0,2=-\frac{450}{T_Q} \)
\(0,2=\frac{450}{T_Q} \)
\(T_Q=\frac{450}{0,2}\)
\(T_Q=2250\ K\)
question 2 (Cefet-PR) Le 2ème principe de la thermodynamique peut être énoncé ainsi: « Il est impossible de construire une machine énergie thermique fonctionnant par cycles, dont le seul effet est d'évacuer la chaleur d'une source et de la convertir intégralement en travail". Par extension, ce principe nous amène à conclure que :
a) Il est toujours possible de construire des machines thermiques dont le rendement est de 100 %.
b) tout moteur thermique n'a besoin que d'une seule source de chaleur.
c) la chaleur et le travail ne sont pas des quantités homogènes.
d) tout moteur thermique puise la chaleur d'une source chaude et rejette une partie de cette chaleur vers une source froide.
e) ce n'est qu'avec une source froide, toujours maintenue à 0 °C, qu'il serait possible pour un certain moteur thermique de convertir entièrement la chaleur en travail.
Résolution:
Variante D. Ce principe nous informe qu'il est impossible d'évacuer toute la chaleur de la source chaude et de la transférer vers la source froide.
Note
|1| Cours de physique de base: Fluides, Oscillations et Ondes, Chaleur (vol. 2).
De Pamella Raphaella Melo
Professeur de physique
Source: École du Brésil - https://brasilescola.uol.com.br/fisica/segunda-lei-da-termodinamica.htm
