Le texte Réactions d'addition ont montré que ces types de réactions organiques sont nommés ainsi parce qu'un réactif est ajouté à la molécule organique en brisant les liaisons entre les carbones. Dans ce texte le cas des alcènes a été montré, ici nous allons déjà considérer comment cela se produit avec les alcynes, ou c'est-à-dire avec les hydrocarbures (formés uniquement par des atomes de carbone et d'hydrogène) qui ont une liaison tripler.
Le point vulnérable des alcynes est exactement la triple liaison, où les liaisons de type pi (π) peuvent être rompues (addition partielle) ou deux fois (addition totale) et donnent lieu, respectivement, à de nouveaux composés avec des liaisons doubles (alcènes) ou simples (alcanes).
Regardons les cas de réactions d'addition dans les alcynes :
1. Ajout d'hydrogène ou hydrogénation :
Dans ce cas, la molécule H2 est ajouté à l'alcyne à l'aide d'un catalyseur, qui est généralement du nickel (Ni), du platine (Pt) ou du palladium (Pd) en poudre. En raison de la nécessité d'utiliser un catalyseur, cette réaction est également appelée
hydrogénation catalytique et cela se fait par étapes: dans la première étape, vous obtenez un alcène, et dans la deuxième étape, qui est plus lente, vous obtenez un alcane.Si le catalyseur utilisé est fort, comme le nickel et le platine, la réaction produit directement un alcane. Palladium mélangé avec BaSO4 c'est un catalyseur faible et produit un alcène. Il est également possible d'utiliser un inhibiteur de catalyseur partiel pour n'atteindre que l'alcène. Cette réaction a également lieu sous des pressions et des températures élevées.
Ensuite, nous avons l'ajout d'hydrogène à l'éthane, produisant de l'éthylène puis de l'éthane :

2. Ajout d'halogènes ou halogénation :
Une liaison pi de l'alcyne est rompue et deux atomes d'halogène sont ajoutés à la molécule (éléments de la famille 17A du tableau périodique, le plus utilisé étant: Cl2 et Br2), formant un dihalogénure vicinal, ce qui signifie que deux atomes d'halogène sont liés à des atomes de carbone voisins. La réaction peut continuer, brisant l'autre liaison pi et ajoutant deux autres atomes d'halogène à la molécule.
Dans l'exemple ci-dessous, nous avons ce type d'ajout au pot-de-vin :
ClCl ClCl
││ ││
H C ≡ C CH3 + Cl2 → H C ═ C CH3 + Cl2 → H C ─ C CH3
││
ClCl
ALCINO DI-HALETTE TETRAHALETTE
3. Ajout d'halogénures d'hydrogène (hydrures halogénés ou hydrohalogénation) :
Ici, un halogénure d'hydrogène est ajouté à l'alcyne, et une addition partielle et totale peut également avoir lieu. Un aspect important de ce type de réaction est qu'il suit le La règle de Markovnikov, c'est-à-dire que l'hydrogène se lie au carbone le plus hydrogéné (avec plus d'atomes d'hydrogène attachés) et l'halogène se lie au carbone le moins hydrogéné.
Dans l'hydrohalogénation totale, il se forme un dihalogénure gémique, c'est-à-dire un composé qui a deux atomes d'halogène liés au même carbone.
Regarder:
HFrère Hfr
││ ││
H C ≡ C CH3 + HBr → H C ═ C CH3 + HBr → H C ─ C CH3
││
Hfr
ALCINO HALOGURE GÉMIQUE DI-HALOGURE
Un exemple important de ce type de réaction est celui qui se produit lorsque du chlorure d'hydrogène est ajouté à l'éthylène, formant le le chloroéthène ou le monochlorure de vinyle, qui est le monomère qui forme le polymère de chlorure de polyvinyle, mieux connu sous son acronyme PVC.
HClHCl
││ ││
H C ≡ C H + HCl → H C ═ C H + HCl → H C ─ C H
││
HCl
ETHINO CHLOROÉTÈNE 1,1-DICHLOROÉTHANE
(PVC monomère)
Le PVC est une substance largement utilisée dans l'industrie pour la fabrication de divers produits, tels que des sandales, des flacons de médicaments, des dispositifs médicaux, des pantalons en plastique pour bébés, des sacs, revêtements métalliques, jouets, garnitures de meubles, garnitures de voitures, imperméables, chaussures en plastique, disques vinyles, sols, films d'emballage, tuyaux utilisés dans les conduites d'eau et les eaux usées, etc.
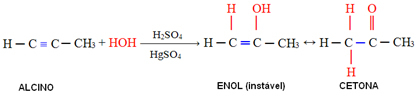
4. Ajout d'eau (hydratation):
Dans cette réaction, l'eau réagit avec l'alcyne, formant initialement un énol, qui subit un réarrangement moléculaire et se transforme en aldéhyde (dans le cas des alcynes plus petits que l'acétylène). L'énol et l'aldéhyde restent en équilibre dynamique avec une prédominance d'aldéhyde. C'est un cas de Isomérie ou tautomérie constitucikonale dynamique.
Exemple:

Dans le cas des alcynes plus gros que l'acétylène, la règle de Markovnikov est suivie et l'énol donne naissance à une cétone :
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcinos.htm

