La formule structurelle est une façon de représenter les liaisons entre les éléments, chaque paire d'électrons partagés entre deux atomes étant symbolisée par un tiret :
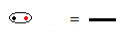
Paire d'électrons partagée symbolisée par un tiret
Cela signifie que tous les types de liaisons covalentes apparaissent dans la formule structurelle, qu'elles soient simples, doubles ou triples :
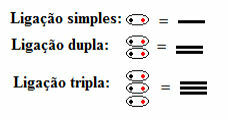
Liaisons simples, doubles et triples symbolisées par des tirets dans les formules structurelles
Regardez quelques exemples de formules structurelles de petites molécules impliquant peu de liaisons et remarquez comment les paires d'électrons partagées sont représentées.
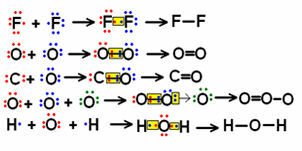
Exemples de formules développées pour certaines molécules
Les formules indiquées ci-dessus à gauche, où les paires électroniques sont symbolisées par des « points », sont appelées formules électroniques ou alors formules de Lewis. Toutes ces molécules sont des substances inorganiques, mais les formules structurales sont généralement plus utilisées dans le cas des composés organiques, qui sont celles formées par l'élément carbone, qui ne sont pas d'origine minérale (comme dans le cas du monoxyde de carbone (CO), qui est considéré inorganique).
Puisque le carbone est tétravalent (il fait quatre liaisons covalentes), il a le grand capacité à se lier à différents atomes et autres carbones, formant une infinité de chaînes carbonique. C'est pourquoi la formule structurelle est importante parce queindique la disposition des atomes dans la chaîne.
Pour comprendre, considérez ce qui suit: a formule moléculaire indique seulement le nombre de chaque élément dans une molécule de la substance. Par exemple, disons que nous avons la formule moléculaire C3H6, on sait alors qu'il a trois atomes de carbone et six atomes d'hydrogène, mais comment sont-ils liés? La formule structurelle nous le dira et nous pourrons en fait découvrir de quel composé il s'agit. Notons ci-dessous que cette formule moléculaire peut donner lieu à deux formules structurales différentes et, par conséquent, à deux substances distinctes :

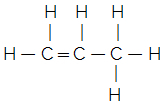
Cyclopropane Propène
Ceux-ci peuvent être appelésformules structurelles plates, dans lequel toutes les connexions et tous les éléments sont dessinés sur le plan du papier, du tableau, de l'écran d'ordinateur, etc.
Cependant, de nombreuses chaînes carbonées sont très grandes et assez complexes, il serait donc difficile d'avoir à écrire la formule structurelle à plat à chaque fois.
Ainsi, d'autres formes de représentation de la structure des molécules ont été créées qui sont plus simplifiées. Le premier est le formule développée simplifiée ou condensée, dans laquelle la quantité d'atomes d'hydrogène attachés à chaque carbone est abrégée en mettant son symbole (H) une seule fois et en ajoutant dans le coin inférieur droit un index, qui est un nombre qui indique combien d'hydrogènes il y a.
Par exemple, considérons la formule structurelle plate de l'éther commun :
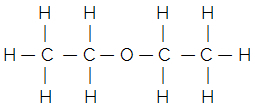
Sa formule développée simplifiée ou condensée est donnée par :
H3C-CH2 — O — CH2 — CH3
Beaucoup plus simple, n'est-ce pas ?!
Mais sachant que le carbone fait toujours quatre liaisons et que l'hydrogène ne fait qu'une liaison, une autre formule encore plus simple a émergé, qui est la formule des tirets. Si vous le souhaitez, vous pouvez voir comment l'écrire plus en détail dans le texte Formules moléculaires des composés organiques. Mais fondamentalement, dans cette formule, les groupes C, CH, CH sont omis2 et CH3, qui sont représentés par des tirets connectés en zigzag. Ci-dessous, nous avons la formule structurelle de l'éther susmentionné :
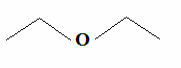
Formule de trace d'éther commun
Il est bien vrai, cependant, que les formules de substance ne sont pas exactement plates dans l'espace. Par conséquent, dans certains cas, pour donner une idée plus spatiale, ils écrivent formules en perspective, où les liens peuvent indiquer si l'atome est dans le plan (trait normal), derrière le plan (coin pointillé) ou devant le plan (coin plein) :

Représentations dans les formules en perspective
Par exemple, regardez la formule du cortisol ci-dessous. Notez qu'un hydrogène, un groupe hydroxyle (OH) et deux groupes méthyle (CH3 – qui sont omis) sont en avant de l'avion, tandis que deux hydrogènes et un groupe hydroxyle sont derrière l'avion, et le reste est dans l'avion.

Formule développée dans la perspective du cortisol
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-formula-estrutural.htm
