Toi des gaz elles sont fluides qui, contrairement aux liquides, occupent tout l'espace disponible du récipient où ils sont confinés. Les molécules qui composent les gaz sont libres de se déplacer et d'interagir entre elles et avec les parois du récipient.
O gaz parfait ou parfait il s'agit d'un gaz idéalisé, doté de caractéristiques particulières et conforme aux loi générale sur les gaz et le L'équation de Clapeyron.
Caractéristiques des gaz parfaits
Il n'y a pas interaction gravitationnelle entre les molécules ;
À collisions parmi les molécules se trouvent parfaitement élastique, c'est-à-dire qu'il y a conservation totale de l'énergie cinétique ;
Les molécules présentent un mouvement désordonné et vitesses qui dépendent directement de la valeur de la température du gaz;
Le volume propre de chaque molécule est totalement insignifiant par rapport au volume total du gaz.
variables d'état
Pression, Température et le volume sont les grandeurs physiques scalaires qui caractérisent un gaz. Ces quantités sont appelées variables d'état et elles entretiennent des relations de proportionnalité.
LES la loi de Boyledétermine que la relation entre la pression et le volume d'un gaz est inversement proportionnelle. Plus la pression sur les molécules est grande, moins elles occupent d'espace.
LES Loi Gay-Lussacdétermine que la relation entre le volume et la température d'un gaz est directement proportionnelle. Plus la température d'un gaz est élevée, plus l'agitation des molécules sera importante, qui auront tendance à s'écarter, augmentant l'espace qu'elles occupent.
la loi de Charles détermine que la relation entre la pression et la température d'un gaz est directement proportionnelle. Plus la température d'un gaz est élevée, plus l'agitation moléculaire est importante. Ainsi, l'incidence des collisions entre les molécules et les parois du récipient augmente, rendant la pression du gaz plus importante.
LES équation de Clapeyron il synthétise les trois lois présentées ci-dessus et détermine une relation unique entre les variables d'état.
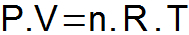
P = pression de gaz (atm ou N/m2);
V = volume de gaz (L ou m3);
n = nombre de moles;
R = constante universelle des gaz (0,082 atm.l/mol. K ou 8,31 J/mol. K);
T = température du gaz (K).
Gaz parfait dans la nature
La nature ne produit pas de gaz ayant les caractéristiques d'un gaz parfait. Le gaz parfait est un modèle théorique et utile pour comprendre le comportement des gaz face à l'évolution de leurs caractéristiques.
Par Joab Silas
Diplômé en Physique
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-gas-perfeito.htm
