Dans la vie de tous les jours et dans les laboratoires, il y a des réactions et des transformations qui sont spontanées et d'autres qui ne le sont pas. Par exemple, toute combustion est une réaction spontanée, car une fois démarrée, elle se poursuivra jusqu'à ce que tout le carburant soit consommé ou jusqu'à ce que tout l'oxygène soit parti.
D'autre part, l'électrolyse est un processus non spontané, dans lequel l'énergie électrique est transformée en énergie chimique. Un exemple est l'électrolyse du chlorure de sodium (NaCl). Lorsqu'un courant électrique est passé sur ce sel fondu, il y a des réactions d'oxydoréduction et la formation de sodium métallique (Na(s)) et le chlore gazeux (Cl2(g)). Si nous arrêtons de faire passer le courant électrique, la réaction ne se poursuivra pas d'elle-même, ce qui montre qu'elle n'est pas spontanée.
La spontanéité d'une réaction peut être mesurée à l'aide de la Équation de Gibbs-Helmholtz, donnée ci-après:

Sur quoi:
∆G = variation d'énergie libre ;
∆H = changement d'enthalpie ;
T = température en Kelvin (toujours positif) ;
∆S = changement d'entropie.
Cette équation tire son nom car elle a été proposée par le physicien américain J. Willard Gibbs (1839-1903) et par le physicien allemand Hermann Helmholtz (1821-1894).
Pour mieux comprendre comment cette équation nous aide à déterminer la spontanéité d'une réaction, passons brièvement en revue chacun des concepts qui la composent :
- ∆H (variation d'enthalpie) : L'enthalpie (H) est le contenu énergétique d'une substance. Jusqu'à présent, aucun moyen de le déterminer n'est connu. En pratique, il s'agit de mesurer la variation d'enthalpie (∆H) d'un procédé, à l'aide de calorimètres. Cette variation correspond au montant de énergie qui a été libérée ou absorbée dans le processus.
- S (variation d'entropie) :L'entropie (S) est la quantité thermodynamique qui mesure le degré de désordre dans un système.
Par exemple, lors de la fonte de la glace, les molécules passent d'un état solide à un état liquide, où il y a une plus grande désorganisation. Cela signifie que dans ce processus, l'entropie a augmenté (∆S > 0).
Dans la production d'ammoniac (NH3), 1 mol d'azote gazeux réagit avec 3 mol d'hydrogène gazeux (c'est-à-dire 4 mol de molécules dans les réactifs), donnant 2 mol d'ammoniac :
N2(g) +3H2(g) → 2 NH3(g)
Comme le nombre de molécules dans la phase gazeuse diminue dans ce processus, la désorganisation a diminué, ce qui signifie que l'entropie a également diminué (∆S< 0).
- G (Énergie libre) : Énergie gratuite ou L'énergie gratuite de Gibbs (parce qu'il n'a été proposé que par ce scientifique en 1878) est l'énergie utile du système qui est utilisé pour faire le travail.
Un système a une énergie globale, mais seule une fraction de cette énergie sera utilisée pour effectuer un travail, c'est ce qu'on appelle l'énergie libre de Gibbs, symbolisée par g.
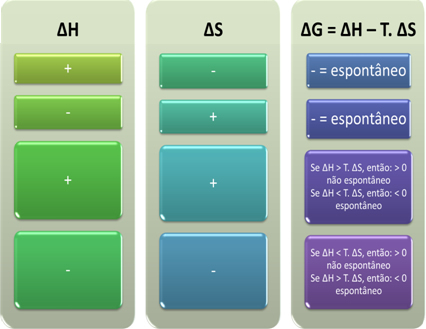
Selon Gibbs, un processus est considéré comme spontané s'il effectue un travail, c'est-à-dire si G diminue. Dans ce cas, l'état final de la transformation sera plus stable que l'état initial lorsque ∆G < 0.
Sur cette base, nous pouvons conclure ce qui suit :

Nous pouvons également voir si un processus sera spontané en regardant le signe algébrique de ∆H et ∆S dans l'équation de Gibbs-Helmholtz :
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm