Habituellement, les réactions de électrolyse aqueuse et électrolyse ignée elles sont réalisées avec des électrodes de graphite et de platine, qui ne participent pas à la réaction; ils ne conduisent que le courant électrique. Cependant, il existe des cas particuliers où il est nécessaire d'utiliser électrodes actives, c'est-à-dire qui subissent une réduction et une oxydation.
Les principaux cas d'utilisation de ces électrodes qui participent au processus redox sont: a purification électrolytique des métaux, tels que le zinc, le cobalt, le nickel et, principalement, le cuivre; et aussi le galvanoplastie. Voyons comment chaque cas se produit :
• Purification électrolytique du cuivre: ce raffinage électrolytique du cuivre peut produire une pureté d'environ 99,9% et est principalement utilisé pour fabriquer fils de cuivre qui, s'ils ont le moins d'impuretés, peuvent avoir leur capacité à conduire un courant très électrique diminué.
Observez comment ce processus se déroule, en voyant le schéma d'une cuve électrolytique assemblée ci-dessous :

Une différence de potentiel est appliquée à la solution aqueuse de sulfate de cuivre (CuSo4(aq)) – qui conduit l'électricité – de sorte que l'anode, qui est un cuivre métallique impur, perd des électrons, c'est-à-dire qu'elle s'oxyde en libérant ses cations (Cu2+), qui sont déposés sur la plaque négative. Cela pourrait être une plaque de platine inerte, ou, mieux, une plaque de cuivre pur. Il constitue la cathode, qui se réduit au fur et à mesure que le cuivre s'y dépose. Ainsi, les semi-réactions qui se produisent dans les électrodes sont :
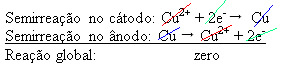
Le fait qu'il ait donné un résultat nul indique qu'il n'y a pas eu de réaction chimique, mais seulement le transport du cuivre. Au fond du récipient se trouvent les autres substances impures qui se trouvaient dans le cuivre comme l'or, l'argent, la silice (sable) et d'autres minéraux, qui peuvent même être vendus.
• Galvanoplastie: un revêtement métallique est appliqué sur un matériau à protéger de la corrosion.
Le métal choisi pour le revêtement - qui peut être du chrome (placage au chrome), du nickel (placage au nickel), de l'argent (placage d'argent), or (dorure) ou zinc (galvanisation) – sera l'anode, électrode positive, qui subit une oxydation, perdant des électrons. Il subit une oxydation à la place du matériau qui a été protégé, car son potentiel de réduction est plus important.
L'électrode négative, c'est-à-dire la cathode, qui reçoit ces électrons et subit une réduction, est le matériau lui-même qui a été enduit. De cette façon, il reste protégé même si sa surface est en quelque sorte violée.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm

